Bài tập luyện tập về Đồng, Crom, hợp chất của Đồng và Crom - Hóa 12 bài 38
Ở các bài học trước các em đã được học về tính chất hóa học của Đồng (Cu), Crom (Cr) các các hợp chất oxit, hidroxit, muối của Đồng và Crom.
Trong bài này chúng ta cùng ôn lại tính chất của Đồng, Crom và các hợp chất Đồng oxit, Đồng hidroxit, muối đồng và Crom oxit, Crom hidroxit, muối Crom. Quan trọng hơn là vận dùng nội dung lý thuyết này để luyện kỹ năng giải các bài tập về đồng, crom và hợp chất của chúng.
I. Tóm tắt kiến thức về Đồng và Crom
1. Cấu hình electron
• Crom (Cr): [Ar] 3d54s1
- Trong hợp chất, crom thể hiện số oxi hóa từ +1 đến +6.
• Đồng (Cu): [Ar] 3d104s1
- Trong hợp chất, đồng thể hiện số oxi hóa +1 và +2.
2. Tính chất của Đồng và Crom
- Crom là kim loại hoạt động hóa học yếu hơn Zn và mạnh hơn Fe, tác dụng với nhiều đơn chất và hợp chất (phản ứng cần đun nóng).
- Đồng là kim loại hoạt động yếu, đứng sau H trong dãy điện hóa học nên không khử được ion H+ của các dung dịch HCl và H2SO4 loãng.
II. Hợp chất của Đồng và Crom
1. Hợp chất của Crom
- Hợp chất crom (III) gồm: crom(III) oxit - Cr2O3, crom (III) hiđroxit - Cr(OH)3.
- Hợp chất crom (VI) gồm: crom(VI) oxit - CrO3, muối crom (VI).
2. Hợp chất của Đồng
Hợp chất của đồng gồm: đồng(II) oxit - CuO, đồng (II) hiđroxit Cu(OH)2, muối đồng (II).
III. Bài tập về Đồng, Crom và hợp chất của Đồng, Crom
* Bài 1 trang 166 SGK Hóa 12: Hoàn thành phương trình hóa học của các phản ứng trong dãy chuyển đổi sau:
Cu → CuS → Cu(NO3)2 → Cu(OH)2 → CuCl2 → Cu.
° Lời giải bài 1 trang 166 SGK Hóa 12:
- Các phương trình phản ứng hóa học:
Cu + S → CuS
3CuS + 14HNO3 → 3Cu(NO3)2 +3H2SO4 + 8NO↑ + 4H2O
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
CuCl2 → Cu +Cl2.
* Bài 2 trang 166 SGK Hóa 12: Khi cho 100 gam hợp kim gồm có Fe, Cr và Al tác dụng với lượng dư dung dịch NaOH thu được 6,72 lít khí. Lấy bã rắn không tan cho tác dụng một lượng dư dung dịch HCl (khi không có không khí) thu 38,08 lít khí. Các thể tích đo ở đktc. Xác định thành phần % của hợp kim.
° Lời giải bài 2 trang 166 SGK Hóa 12:
- Khi cho hợp kim gồm có Fe, Cr và Al tác dụng với lượng dư dung dịch NaOH thì chỉ có Al tham gia phản ứng theo phương trình hóa học sau:
2Al + 2NaOH → 2NaAlO2 + 3H2↑ (1)
- Còn Fe, Cr không tham gia phản ứng nên không tan, sẽ tác dụng với HCl theo PTPƯ
Fe + 2HCl → FeCl2 + H2↑ (2)
Cr + 2HCl → CrCl2 + H2↑ (3)
- Theo bài ra và theo PTPƯ (1) thì thu được 6,72 lít khí nên:
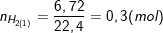
- Cũng theo PTPƯ (1) thì:
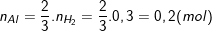
⇒ Khối lượng của Al là: mAl = 27. 0,2 = 5,4 (g).
⇒ Khối lượng của Cr và Fe là:
m(Cr+Fe) = m(hợp kim) - mAl = 100 - 5,4 = 94,6(g).
- Khi Cr và Fe tác dụng với HCl thu được 38,08 lít khí nên có:
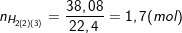
- Gọi x, y lần lượt là số mol của Fe, Cr như vậy ta có:
56x + 52y = 94,6 (*)
- Theo PTPƯ (2) và (3) ta có: x + y = 1,7 (**)
- Giải hệ từ PT (*) và (**) ta được: x = 1,55 và y = 0,15
⇒ mFe = 1,55.56 = 86,8 (g).
⇒ mCr = 0,15.52 = 7,8 (g).
- Vậy thành phần % theo khối lượng của hỗn hợp là :
%Fe = 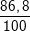 .100% = 86,8%
.100% = 86,8%
%Cr = 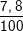 .100% = 7,8%
.100% = 7,8%
%Al = 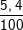 .100% = 5,4%
.100% = 5,4%
* Bài 3 trang 167 SGK Hóa 12: Hỗn hợp X gồm Cu và Fe trong đó Cu chiếm 43,24% khối lượng. Cho 14,8 gam X tác dụng với dung dịch HCl thấy có V lít khí (đktc) bay ra. Giá trị của V là:
A. 1,12 lít B. 2,24 lít C. 4,48 lít D. 3,36 lít
° Lời giải bài 3 trang 167 SGK Hóa 12:
• Chọn đáp án: D. 3,36 lít
- Hỗn hợp X gồm Cu và Fe trong đó Cu chiếm 43,24% nên %Fe = 100% - 43,24% = 56,76%.
- Khối lượng của Fe trong 14,8 gam X là:
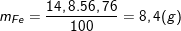
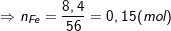
- Khi X tác dụng với dung dịch HCl thì chỉ có Fe tham gia phản ứng:
Fe + 2HCl → FeCl2 + H2↑
0,15 0,15(mol)
- Theo PTPƯ thì nH2 = nFe = 0,15(mol) nên thể tích khí H2 bay ra là:
VH2 = =n.22,4 = 0,15.22,4 = 3,36(l).
* Bài 4 trang 167 SGK Hóa 12: Khử m gam bột CuO bằng khí H2 ở nhiệt độ cao thu được hỗn hợp chất rắn X. Để hòa tan hết X cần vừa đủ 1 lít dung dịch HNO3 1M, thu được 4,48 lít NO (đktc). Hiệu suất của phản ứng khử CuO bằng bao nhiêu?
A. 70% B. 75% C. 80% D. 85%
° Lời giải bài 4 trang 167 SGK Hóa 12:
• Chọn đáp án: B. 75%
- Số mol HNO3 (1 lít dung dịch HNO3 1M): nHNO3 = 1.1 = 1(mol)
- Số mol khí NO (4,48 lít NO ở đktc): 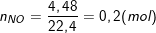
- Phương trình phản ứng:
CuO + H2 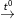 Cu + H2O (1)
Cu + H2O (1)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O (2)
- Theo PTPƯ (2) ta có nHNO3 = 4.nNO = 4.0,2 = 0,8 (mol).
- Theo bài ra cần 1 mol để hòa tan vừa đủ X, như vậy số mol HNO3 còn lại là: nHNO3 còn lại = 1 - 0,8 = 0,2 (mol).
⇒ Trong hỗn hợp X còn CuO dư phản ứng với HNO3
CuO + 2HNO3 → Cu(NO3)2 + H2O (3)
- Ta có: nNO = 0,2(mol)
- Theo PTPƯ (2) ta có:
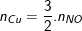
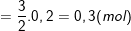 ;
;
- Theo PTPƯ (3) thì nHNO3 = 0,2 (mol), ta có:
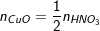
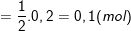
⇒ nCuO (ban đầu) = nCu + nCuO(dư) = 0,3 + 0,1 = 0,4 (mol)
- Hiệu suất của quá trình khử CuO là: 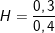 .100% = 75%
.100% = 75%
* Bài 5 trang 167 SGK Hóa 12: Nhúng thanh sắt vào dung dịch CuSO4 sau một thời gian lấy thanh sắt ra rửa sạch sấy khô thấy khối lượng tăng 1,2 gam. Có bao nhiêu gam Cu đã bám vào thanh sắt?
A. 9,3 gam. B. 9,4 gam. C. 9,5 gam. D. 9,6 gam.
° Lời giải bài 5 trang 167 SGK Hóa 12:
• Chọn đáp án: D. 9,6 gam.
- Gọi x là số mol Fe tham gia phản ứng
Fe + CuSO4 → FeSO4 + Cu
x x (mol)
- Theo PTPƯ ta thấy khối lượng thanh sắt tăng lên chính là có thêm khối lượng của đồng bám vào (1 lượng x mol sắt bị tan ra, 1 lượng x mol đồng bám vào), nên có:
64x - 56x = 1,2 ⇒ 8x = 1,2 ⇒ x = 0,15 (mol)
- Khối lượng Cu bám vào sắt là: mCu = 0,15.64 = 9,6 (g).
* Bài 6 trang 167 SGK Hóa 12: Cho Cu tác dụng với dung dịch hỗn hợp gồm NaNO3 và H2SO4 loãng sẽ giải phóng khí nào sau đây?
A. NO2. B. NO. C. N2O. D. NH3.
° Lời giải bài 6 trang 167 SGK Hóa 12:
• Chọn đáp án: B. NO.
- Phương trình phản ứng:
3Cu + 2NaNO3 + 4H2SO4 → 3CuSO4 + Na2SO4 + 2NO↑ + 4H2O
Hy vọng với bài viết về Bài tập luyện tập về Đồng, Crom, hợp chất của Đồng và Crom ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
» Mục lục sách giáo khoa SGK Hóa học 12 Lý thuyết và Bài tập
Đánh giá & nhận xét
-
 Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 29 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 29 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 29 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 29 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 29 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 29 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 4 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 20 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 20 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 20 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 20 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 20 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 20 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 14 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 14 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 14 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 14 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 10 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 10 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 10 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 10 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 10 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 10 Hóa 12 Chân trời sáng tạo SGK
-
 Ôn tập chương 8: Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất? Hóa 12 bài 30 KNTT (Kết nối tri thức)
Ôn tập chương 8: Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất? Hóa 12 bài 30 KNTT (Kết nối tri thức)
-
 Tính chất và Ứng dụng của phức chất? Phản ứng tạo phức chất và phản ứng thế phối tử phức chất? Hóa 12 bài 29 KNTT
Tính chất và Ứng dụng của phức chất? Phản ứng tạo phức chất và phản ứng thế phối tử phức chất? Hóa 12 bài 29 KNTT
-
 Khái niệm phức chất? dạng hình học của phức chất và liên kết trong phức chất? Hóa 12 bài 28 KNTT
Khái niệm phức chất? dạng hình học của phức chất và liên kết trong phức chất? Hóa 12 bài 28 KNTT
-
 Đơn chất và hợp chất kim loại chuyển tiếp dãy thứ nhất, đặc điểm cấu tạo, tính chất vật lí? Hóa 12 bài 27 KNTT
Đơn chất và hợp chất kim loại chuyển tiếp dãy thứ nhất, đặc điểm cấu tạo, tính chất vật lí? Hóa 12 bài 27 KNTT
-
 Ôn tập chương 7: Pin điện và điện phân? Hóa 12 bài 26 KNTT (Kết nối tri thức)
Ôn tập chương 7: Pin điện và điện phân? Hóa 12 bài 26 KNTT (Kết nối tri thức)
-
 Nguyên tố nhóm IIA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IIA? Hóa 12 bài 25 KNTT
Nguyên tố nhóm IIA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IIA? Hóa 12 bài 25 KNTT
-
 Nguyên tố nhóm IA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IA? Hóa 12 bài 24 KNTT
Nguyên tố nhóm IA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IA? Hóa 12 bài 24 KNTT
-
 Ôn tập chương 6: Đại cương về Kim loại? Hóa 12 bài 23 KNTT (Kết nối tri thức)
Ôn tập chương 6: Đại cương về Kim loại? Hóa 12 bài 23 KNTT (Kết nối tri thức)


















































