Bài tập luyện tập tính chất hóa học của Nhôm và hợp chất của nhôm - Hóa 12 bài 29
Ở các bài học trước các em đã biết tính chất hóa học của nhôm Al và các hợp chất quan trọng của nhôm như nhôm oxit hay nhôm hidroxit
Trong bài viết này, chúng ta cùng ôn tập lại một số tính chất hóa học của nhôm Al và các hợp chất quan trọng của nhôm. Đồng thời rèn luyện kỹ năng giải một số bài tập về nhôm và các hợp chất quan trọng của kim loại này.
I. Tóm tắt lý thuyết cần nhớ
1. Tính chất của Nhôm
• Vị trí trong bảng tuần hoàn: Nhôm ở ô số 13, nhóm IIIA, chu kì 3.
• Tính chất vật lý: Nhôm là kim loại nhẹ (D = 2,7g/cm3), dẫn điện, dẫn nhiệt tốt, dẻo.
• Tính chất hóa học:
- Nhôm là kim loại có tính khử mạnh (chỉ sau kim loại kiềm và kiềm thổ)
Al → Al3+ + 3e
- Trên thực tế nhôm không tác dụng với O2 không khí vì nhôm có lớp màng oxit bảo vệ.
- Nhôm bị phá hủy trong môi trường kiềm.
2. Hợp chất của nhôm
a) Nhóm oxit
- Nhôm oxit là oxit lưỡng tính: vừa tan được trong dung dịch axit vừa tan được trong kiềm mạnh.
b) Nhóm hidroxit
- Nhôm hiđroxit là hidroxit lưỡng tính, vừa tan trong dung dịch axit, vừa tan trong dung dịch kiềm mạnh.
c) Nhóm sunfat
- Phèn chua: K2SO4.Al2(SO4)3.24H2O
- Phèn nhôm: M2SO4.Al2(SO4)3.24H2O (M+ là Na+; Li+; NH4+)
II. Bài tập về Nhôm và hợp chất của nhôm
* Bài 1 trang 134 SGK Hóa 12: Nhôm bền trong môi trường không khí và nước là do
A. Nhôm là kim loại kém hoạt động.
B. Có màng oxit Al2O3 bền vững bảo vệ.
C. Có màng hiđroxit Al(OH)3 bền vững bảo vệ.
D. Nhôm có tính thụ động với không khí và nước.
° Lời giải bài 1 trang 134 SGK Hóa 12:
• Chọn đáp án: B. Có màng oxit Al2O3 bền vững bảo vệ.
* Bài 2 trang 134 SGK Hóa 12: Nhôm không tan trong dung dịch nào sau đây?
A. HCl. B. H2SO4. C. NaHSO4. D. NH3.
° Lời giải bài 2 trang 134 SGK Hóa 12:
• Chọn đáp án: D. NH3.
- Nhôm không tan trong dung dịch NH3. PTPƯ của Al với các dung dịch còn lại:
2Al + 6HCl → 2AlCl3 + 3H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
2Al + 6NaHSO4→ 3Na2SO4 + Al2(SO4)3 + 3H2↑
* Bài 3 trang 134 SGK Hóa 12: Cho 31,2 gam hỗn hợp bột Al và Al2O3 tác dụng hết với dung dịch NaOH dư thu được 13,44 lít H2 ở đktc. Khối lượng từng chất trong hỗn hợp ban đầu lần lượt là:
A. 16,2 gam và 15 gam.
B. 10,8 gam và 20,4 gam.
C. 6,4 gam và 24,8 gam.
D. 11,2 gam và 20 gam.
° Lời giải bài 3 trang 134 SGK Hóa 12:
• Chọn đáp án: B. 10,8 gam và 20,4 gam.
- Theo bài ra, thu được 13,44 lít H2 ở đktc nên:
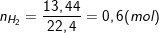
- PTPƯ của Al và Al2O3 với NaOH
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↓ (1)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (2)
- Theo PTPƯ (1) thì ta có:
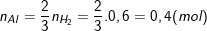
⇒ mAl = 0,4.27 = 10,8 (g);
⇒ mAl2O3 = 31,2 - 10,8 = 20,4 (g).
* Bài 4 trang 134 SGK Hóa 12: Chỉ dùng thêm 1 hóa chất, hãy phân biệt các chất trong những dãy sau và viết phương trình hóa học để giải thích.
a) Các kim loại: Al, Mg, Ca, Na.
b) Các dung dịch: NaCl, CaCl2, AlCl3.
c) Các chất bột: CaO, MgO, Al2O3.
° Lời giải bài 4 trang 134 SGK Hóa 12:
a) Nhận biết Al, Mg , Ca, Na
• Cho nước vào 4 mẫu thử:
- Mẫu kim loại tan trong nước tạo thành dung dịch trong suốt là Na
- Mẫu kim loại tan trong nước tạo dung dịch vẩn đục là Ca
2Na + 2H2O → 2NaOH + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
- Hai mẫu thử không tan trong nước là Al và Mg
- Hai kim loại không tan trong nước ta cho dung dịch NaOH vào, kim loại nào phản ứng có khí bay ra là Al, còn lại là Mg
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
b) Nhận biết các dung dịch NaCl, CaCl2, AlCl3
• Cho dung dịch NaOH vào 3 mẫu thử:
- Mẫu thử nào xuất hiện kết tủa, sau đó kết tủa tan là: AlCl3.
- Mẫu thử nào dung dịch có vẩn đục là CaCl2
- Mẫu thử nào dung dịch trong suốt là NaCl.
- Các phương trình phản ứng:
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3↓ + NaOH → NaAlO2 + 2H2O
CaCl2 + 2NaOH → Ca(OH)2 + 2NaCl
c) Nhận biết các chất bột CaO, MgO, Al2O3
- Cho nước vào 3 mẫu thử, mẫu thử nào tan trong nước là CaO, hai mẫu thử không tan trong nước là MgO và Al2O3
CaO + H2O → Ca(OH)2
- Lấy Ca(OH)2 ở trên cho vào 2 mẫu thử không tan trong nước. Mẫu thử nào tan ra là Al2O3, còn lại là MgO
Ca(OH)2 + Al2O3 → Ca(AlO2)2 + H2O
* Bài 5 trang 134 SGK Hóa 12: Viết phương trình hóa học để giải thích các hiện tượng xảy ra khi.
a) Cho dung dịch NH3 dư vào dung dịch AlCl3.
b) Cho từ từ dung dịch NaOH đến dư vào dung dịch AlCl3.
c) Cho từ từ dung dịch Al2(SO4)3 vào dung dịch NaOH và ngược lại.
d) Sục từ từ đến dư khi CO2 vào dung dịch NaAlO2.
e) Cho từ từ đến dư dung dịch HCl vào dung dịch NaAlO2.
° Lời giải bài 5 trang 134 SGK Hóa 12:
a) Cho dd NH3 dư vào dd AlCl3 xuất hiện kết tủa trắng keo Al(OH)3
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓trắng + 3NH4Cl
b) Cho từ từ dd NaOH đến dư vào dung dịch AlCl3 ban đầu xuất hiện kết tủa trắng keo Al(OH)3, sau đó kết tủa tan ra dung dịch trở lại trong suốt
AlCl3 + 3NaOH → Al(OH)3↓trắng + 3NaCl
Al(OH)3↓ + NaOH → NaAlO2 + 2H2O
c) Cho từ từ dd Al2(SO4)3 vào dung dịch NaOH xuất hiện kết tủa trắng keo Al(OH)3 sau đó kết tủa tan ngay.
- Ngược lại cho từ từ dung dịch NaOH vào dung dịch Al2(SO4)3 ban đầu sẽ có kết tủa trắng keo Al(OH)3, sau đó khi NaOH dư thì kết tủa tan ra.
Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4
Al(OH)3↓ + NaOH → NaAlO2 + 2H2O
d) Sục từ từ khí CO2 vào dung dịch Na[Al(OH)4], xuất hiện kết tủa trắng keo Al(OH)3
NaAlO2 + 2H2O + CO2 → NaHCO3 + Al(OH)3↓
e) Cho từ từ đến dư dung dịch HCl vào dd Na[Al(OH)4].
- Ban đầu xuất hiện kết tủa trắng keo của Al(OH)3 sau đó khi HCl dư thì kết tủa tan ra
2NaAlO2 + 2HCl + 2H2O → 2NaCl + 2Al(OH)3↓
3HCl + Al(OH)3↓ → AlCl3 + 3H2O
* Bài 6 trang 134 SGK Hóa 12: Hỗn hợp X gồm hai kim loại K và Al có khối lượng 10,5 gam. Hòa tan hoàn toàn hỗn hợp X trong nước được dung dịch A. Thêm từ từ dung dịch HCl 1M vào dung dịch A: lúc đầu không có kết tủa, khi thêm được 100 ml dung dịch HCl 1M thì bắt đầu có kết tủa. Tính thành phần % số mol của các kim loại trong X.
° Lời giải bài 6 trang 134 SGK Hóa 12:
- Gọi x, y lần lượt là số mol của K và Al có trong hỗn hợp
- Ta có các PTPƯ:
2K + 2H2O → 2KOH + H2↑ (1)
x x(mol)
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2↑ (2)
y y y(mol)
- Khi thêm HCl vào dd A, lúc đầu không có kết tủa, sau đó mới có kết tủa nên dung dịch A có KOH dư;
- Như vậy dd A gồm: KOH dư: x - y (mol) và KAlO2 : y (mol)
HCl + KOH → KCl + H2O (3)
(x-y) (x-y)mol
- Khi HCl trung hòa hết KOH dư thì xuất hiện kết tủa:
KAlO2 + HCl + H2O → Al(OH)3↓ + KCl (4)
- Theo bài ra, khi thêm được 100 ml dung dịch HCl 1M thì bắt đầu có kết tủa; như vậy để trung hòa KOH dư cần 100 ml dung dịch HCl 1M.
- Ta có: nHCl = nKOH(3) = x - y = 0,1.1 = 0,1 (mol) (*)
- Mặt khác, theo bài ra hai kim loại K và Al có khối lượng 10,5 gam nên có:
39x + 27y = 10,5 (**)
- Giải hệ từ (*) và (**) ta được x = 0,2; y = 0,1.
- Vậy phần trăm số mol của K và Al trong hỗn hợp là:
%nK = (0,2/0,3) .100% = 66,67%;
%nAl = 100% - 66,67% = 33,33%.
Hy vọng với bài viết về Bài tập luyện tập tính chất hóa học của Nhôm và hợp chất của nhôm ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
» Mục lục sách giáo khoa SGK Hóa học 12 Lý thuyết và Bài tập
Đánh giá & nhận xét
-
 Giải bài 4 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 4 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 54 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 54 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 54 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 54 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK


















































