Bài tập Kim loại tác dụng với Axit, Muối và Cách giải - Hóa 12 chuyên đề
Kim loại tác dụng với Axit (HCl, H2SO4, HNO3,...) hay Kim loại tác dụng với muối là một trong những dạng bài tập rất phổ biến trong hóa học vô cơ. Đây là dạng bài tập tương đối khó và gây khá nhiều khó khăn cho các bạn học sinh.
Vì vậy, bài viết này chúng ta cùng tìm hiểu về cách giải bài tập kim loại tác dụng với axit, muối một cách chi tiết, để qua đó giúp các em cảm thấy thoải mái hơn mỗi khi gặp dạng bài tập này.
I. Cách giải bài tập kim loại tác dụng với axit, muối
1. Cách giải bài tập Kim loại tác dụng với axit
- Phản ứng của kim loại với axit là phản ứng oxi hóa - khử vì vậy có thể vận dụng phương pháp bảo toàn electron.
• Đối với dung dịch axit HCl, H2SO4 loãng: Cr và Fe bị H+ của axit oxi hóa thành Cr2+, Fe2+ còn Cu không phản ứng.
• Đối với axit H2SO4 đặc nguội, HNO3
- Kim loại Cu tan (tức Cu có tham gia phản ứng)
- Kim loại Fe, Al, Cr bị thụ động (không phản ứng) trong HNO3 đặc nguội và H2SO4 đặc nguội.
• Đối với axit H2SO4 đặc nóng, HNO3 loãng, HNO3 đặc nóng
- Kim loại Fe và Cr bị oxi hóa thành Fe3+, Cr3+
- Trong khi đó S6+ và N5+ (trong axit) bị khử về mức oxi hóa thấp hơn: S4+; N4+; N2+ (trong:SO2, NO2 hay NO)...;
> Lưu ý: Nếu kim loại còn dư, thì thu được muối của sắt II và có thể muối sắt III dư.
2. Cách giải bài tập kim loại tác dụng với muối
- Các phản ứng này vận dụng dãy điện hóa của kim loại: Kim loại mạnh đẩy kim loại yếu hơn ra khỏi muối như: Ag, Hg,...
- Với dạng bài tập này (Kim loại mạnh đẩy kim loại yếu hơn ra khỏi muối) có sự thay đổi về khối lượng nên vận dụng phương pháp tăng giảm khối lượng.
Dãy điện hóa kim loại: K, Na, Ba, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
II. Bài tập kim loại tác dụng với axit, muối
* Bài tập 1: Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Tính giá trị tối thiểu của V?
* Lời giải:
- Theo bài ra, Số mol Fe là: nFe = 1,12/56 = 0,02 mol;
số mol Cu là: nCu = 1,92/64 = 0,03 mol;
400ml = 0,4 lít; nH2SO4 = 0,5.0,4 = 0,2(mol)
nNaNO3 = 0,4.0,2 = 0,08(mol).
Nên số mol H+ là: nH+ = 2nH2SO4 = 2.0,2 = 0,4 mol;
Số mol NO3- là: nNO3- = nNaNO3 = 0,08 mol
- Các phản ứng xảy ra:
Fe + 4H+ + NO3- → Fe3+ + NO↑ + 2H2O
0,02 0,08 0,02 0,02
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑ + 4H2O
0,03 0,08 0,02 0,03
Sau 2 phản ứng trên, trong dung dịch X có 0,02 mol Fe3+; 0,03 mol Cu2+ và 0,24 mol H+ dư, ngoài ra còn có ion NO3- và SO42-.
Tuy nhiên chỉ có 3 loại ion đầu là phản ứng với OH-.
H+ + OH- → H2O
0,24 0,24
Fe3+ + 3OH- → Fe(OH)3
0,02 0,06
Fe2+ + 2OH- → Cu(OH)2
0,03 0,06
Vậy tổng số mol OH- là: nOH- = 0,24 + 0,06 + 0,06 = 0,36 mol
⇒ nNaOH = nOH- = 0,36mol;
Suy ra thể tích NaOH cần dùng là:
Vdd(NaOH) = n/CM = 0,36/1 = 0,36 lít = 360ml.
* Bài tập 2: Ngâm 15 gam hỗn hợp Fe và Cu trong dung dịch CuSO4 dư. Phản ứng xong thu được 16 gam chất rắn. Tính thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu?
* Lời giải:
- Ta có PTPƯ (CuSO4 dư nên Fe phản ứng hết):
Fe + 2CuSO4 → FeSO4 + Cu
a(mol) a(mol)
- Theo bài ra, khối lượng chất rắn thu được là 16 gam, khối lượng hỗn hợp ban đầu là 15 gam.
Theo PTPƯ ta có (khối lượng chất rắn tăng): mtăng = 64a - 56a = 16 - 15
⇒ (64 - 56).a = 1 ⇒ a = 0,125 mol
nên nFe = 0,125 ⇒ mFe = 0,125.56 = 7(g)
Suy ra khối lượng của Cu trong hỗn hợp là: mCu = 15 - 7 = 8(g);
Thành phần phần trăm theo khối lượng:
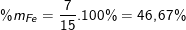
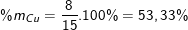
(hoặc %mCu = 100% - %mFe = 100% - 46,67 = 53,33%).
* Bài tập 3: Cho 4,15 gam hỗn hợp Fe, Al phản ứng với 200 ml dung dịch CuSO4 0,525M. khuấy kỹ hỗn hợp để phản ứng xảy ra hoàn toàn. Đem lọc kết tủa (A) gồm hai kim loại nặng 7,84 gam và dung dịch nước lọc B. Để hòa tan kết tủa A cần ít nhất bao nhiêu lít dung dịch HNO3 2M biết phản ứng tạo ra NO.
* Lời giải:
Phản ứng xảy ra với Al trước, sau đó đến Fe. Theo giả thiết, kim loại sinh ra là Cu (kim loại hóa trị II).
Đổi đơn vị: 200ml = 0,2lít;
Theo bài ra: nCuSO4 = V.CM = 0,2.0,525 = 0,105 (mol)
- Gọi x là số mol Al, y là số mol Fe phản ứng và z là số mol Fe dư:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
x 1,5x 1,5x (mol)
Fe + CuSO4 → FeSO4 + Cu
y y y(mol)
Theo bài ra, ta có: 27x + 56(y + z) = 4,15 (*)
Theo PTPƯ, ta có: nCuSO4 = 1,5x + y = 0,105 (**)
Theo bài ra, khối lượng A là: 64(1,5x + y) + 56z = 7,84 (***)
- PTPƯ với HNO3:
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
z 4z (mol)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
(1,5x+y) (8/3)(1,5x + y)
Theo PTPƯ trên thì số mol HNO3 cần dùng là:
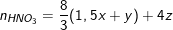
Từ(*), (**) và (***) suy ra: z = 0,02(mol); x = 0,05; y = 0,03
Suy ra, nHNO3 = 0,28 + 0,08 = 0,36(mol)
Vậy thể tích dung dịch HNO3 2M cần dùng là:
V = n/CM = 0,36/2 = 0,18(lít) = 180ml.
* Bài tập 4: Cho 100 gam hợp kim của Fe, Cr, Al tác dụng với một lượng dư dung dịch NaOH thu được 5,04 lít khí. Lấy bã rắn không tan cho tác dụng với một lượng dư dung dịch HCl (không có không khí ) thu được 38,8 lít khí. Các thể tích khí đo ở đktc. Xác định thành phần % của hợp kim.
* Lời giải:
- Khi hợp kim tác dụng với NaOH chỉ có Al phản ứng.
Theo bài ra, nH2 = V/22,4 = 5,04/22,4 = 0,225(mol)
- Các phương trình Phản ứng:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ (1)
Fe + 2HCl → FeCl2 + H2↑ (2)
Cr + 2HCl → CrCl2 + H2↑ (3)
Từ (1) ⇒ nAl = (2/3).nH2 = (2/3).0,225 = 0,15(mol)
⇒ Khối lượng của nhôm trong hợp kim là:
mAl = n.M = 0,15.27 = 4,05(gam)
Suy ra khối lượng của crom và sắt trong hợp kim là:
mCr + Fe = 100 - 4,05 = 95,95(gam)
- Gọi x, y làn lượt là số mol Fe và Cr.
- Theo đề bài ta có hệ phương trình:
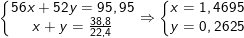
Khối lượng của sắt là: mFe = 1,4695.56 = 82,292(g).
Khối lượng của crom là: mCr = 0,2625.52 = 13,65(g).
Vậy phần trăm khối lượng của các chất trong hợp kim là:
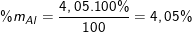
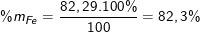
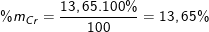
(hoặc %mCr = 100% - %mAl - %mFe = 100% - 4,05% - 82,3% = 13,65%)
*Bài tập 5: Cho 2,24 gam bột sắt vào 100ml dung dịch hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M khuấy đều cho tới khi phản ứng xảy ra hoàn toàn thu được chất rắn A và dung dịch B. Tính khối lượng chất rắn A?
* Lời giải:
- Theo bài ra, ta có: nFe = 2,24/56 = 0,04(mol)
100ml = 0,1 lít; nAgNO3 = CM.V = 0,1.0,1 = 0,01mol;
nCu(NO3)2 = 0,1.0,5 = 0,05(mol);
- Các PTPƯ xảy ra theo thứ tự:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓ (1)
0,005 ← 0,01mol → 0,01
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓ (2)
0,035 → 0,035mol 0,035
Ở PTPƯ (1) AgNO3 phản ứng hết 0,01 mol cần 0,005 mol Fe
Nên số mol Fe còn lại là: 0,04 - 0,005 = 0,035(mol)
Do Cu(NO3)2 = 0,05 mol nên như theo PTPƯ (2) thì Fe sẽ pư hết 0,035mol.
Như vậy, Fe tan hết
Khối lượng của chất rắn A gồm Cu và Ag là:
mA = 0,01.108 + 0,035.64 = 1,08 +2,24 = 3,32g.
Hy vọng với bài viết Bài tập Kim loại tác dụng với Axit, Muối và Cách giải ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để hayhochoi ghi nhận và hỗ trợ, chúc các em học tốt.
Đánh giá & nhận xét
-
 Giải bài 4 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 4 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 54 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 54 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 54 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 54 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK


















































