Giải bài 5 trang 49 SGK Hoá 11: Tính chất hoá học của Photpho (P), tính chất vật lí và ứng dụng của Photpho
Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH...
Bài 5 trang 50 SGK hóa 11: Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4.
a) Viết phương trình hoá học của các phản ứng xảy ra?
b) Tính khối lượng dung dịch NaOH đã dùng?
c) Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng?
Giải bài 5 trang 50 SGK hóa 11:
a) Phương trình phản ứng:
4P + 5O2 → 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)

b) Tính khối lượng dung dịch NaOH
- Theo bài ra ta có số mol photpho: nP = 6,2/31 = 0,2(mol).
⇒ nP2O5 = (1/2)nP =(1/2).0,2 = 0,1 (mol).
- Theo PTPƯ ta có: nNaOH = 4.nP2O5 = 4.0,1 = 0,4 (mol).
⇒ Khối lượng NaOH: mNaOH = n.M = 0,4.40 = 16 (g).
- Từ công thức: C% = 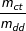 *100%
*100%
⇒ khối lượng dung dịch NaOH:
mNaOH dung dịch = (mct.100%)/(C%) = 16.(100/32) = 50,0 (g).
c) Tính nồng độ phần trăm của muối
- Theo PTPƯ: nNa2HPO4 = 2.nP2O5 = 0,1.2 = 0,2 (mol)
⇒ mNa2HPO4 = n.M = 0,2.142 = 28,4 (g)
- Theo định luật bảo toàn khối lượng: Khối lượng dung dịch sau phản ứng = khối lượng các chất tham gia phản ứng = mNaOH + mP2O5 = 50 + 0,1.142 = 64,2 (g).
⇒ C% Na2HPO4 = (28,4/64,2).100% = 44,24%
Hy vọng với lời giải bài 5 trang 50 SGK Hoá 11 ở trên đã giúp các em hiểu và nắm vững phần kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Hay Học Hỏi ghi nhận và hỗ trợ, chúc các em học tốt.
• Xem các bài tập Hoá 11 cùng chuyên mục
Đánh giá & nhận xét
-
 Giải bài 3 trang 107 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 107 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 107 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 107 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 107 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 107 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 98 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 98 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 98 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 98 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 98 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 98 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 51 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 51 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 51 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 51 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 51 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 51 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Bài 5 trang 91 SGK Hoá 11 Cánh diều
Bài 5 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 91 SGK Hoá 11 Cánh diều
Bài 4 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 91 SGK Hoá 11 Cánh diều: Nhận Biết Ethane, Ethylene, Acetylene
Bài 3 trang 91 SGK Hoá 11 Cánh diều: Nhận Biết Ethane, Ethylene, Acetylene
-
 Bài 2 trang 91 SGK Hoá 11 Cánh diều
Bài 2 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 91 SGK Hoá 11 Cánh diều
Bài 1 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 6 trang 99 SGK Hoá 11 Cánh diều
Bài 6 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 5 trang 99 SGK Hoá 11 Cánh diều
Bài 5 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 99 SGK Hoá 11 Cánh diều
Bài 4 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 99 SGK Hoá 11 Cánh diều
Bài 3 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 2 trang 99 SGK Hoá 11 Cánh diều
Bài 2 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 99 SGK Hoá 11 Cánh diều
Bài 1 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen & Nhiệt Hóa Học
Bài 3 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen & Nhiệt Hóa Học
-
 Bài 2 trang 106 SGK Hoá 11 Cánh diều
Bài 2 trang 106 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen
Bài 1 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen
-
 Bài 5 trang 71 SGK Hoá 11 Cánh diều
Bài 5 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 71 SGK Hoá 11 Cánh diều
Bài 4 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 71 SGK Hoá 11 Cánh diều
Bài 3 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 2 trang 71 SGK Hoá 11 Cánh diều
Bài 2 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 71 SGK Hoá 11 Cánh diều
Bài 1 trang 71 SGK Hoá 11 Cánh diều
-
 Giải bài 4 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 4 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 5 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 5 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 3 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 3 trang 71 Hóa 11 Cánh Diều SGK


















































