Giải bài 1 trang 10 SGK Hoá 11: Axit Bazơ và Muối
Phát biểu các định nghĩa axit, axit một nấc và nhiều nấc, bazơ, hiđroxit lưỡng tính, muối trung hoà, muối axit?...
Bài 1 trang 10 sgk hóa 11: Phát biểu các định nghĩa axit, axit một nấc và nhiều nấc, bazơ, hiđroxit lưỡng tính, muối trung hoà, muối axit? Lấy các thí dụ minh hoạ và viết phương trình điện li của chúng.
Giải bài 1 trang 10 sgk hóa 11:
• Axit: là những chất phân li trong nước ra ion H+, ví dụ:
HCl → H+ + Cl-
H2S ⇌ 2H+ + S2-
• Axit một nấc: là những axit chỉ phân li một nấc ra ion H+ thí dụ như HCl, HBr…
HCl → H+ + Cl-
• Axit nhiều nấc là những axit phân li nhiều lần ra H+, ví dụ:
| H2S là axit hai nấc |
H2S ⇔ H+ + HS- HS- ⇌ H+ + S2- |
| H3PO4 là axit ba nấc |
H3PO4 ⇌ H+ + H2PO4- H2PO4- ⇌ H+ + HPO42- HPO42- ⇌ H+ + PO43- |
• Bazơ là những chất khi tan trong nước phân li ra ion OH-
Ba(OH)2 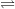 Ba2+ + 2OH-
Ba2+ + 2OH-
• Hiđroxit lưỡng tính: là những chất khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
- Ví dụ: Zn(OH)2, Al(OH)3, Be(OH)2…
+ phân li kiểu bazơ: Al(OH)3 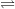 Al3+ + 3OH-
Al3+ + 3OH-
+ phân li kiểu axit: HAlO2 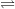 AlO2- + H+
AlO2- + H+
(Khi đó: Al(OH)3 viết dưới dạng axit HAlO2.H2O)
• Muối trung hoà: là những muối mà phân tử không còn khả năng phân li ra ion H+
- Ví dụ: NaCl, K2SO4, NaHPO3, CaCO3, Al(NO3)3 ,...
Al(NO3)3 → Al3+ + 3NO3-
• Muối axit: là muối mà trong phân tử vẫn còn hiđro có khả năng phân li ra ion H+
- Ví dụ: NaHSO4, NaHCO3, KH2PO4, K2HPO2 ,...
NaHSO4 → Na+ + HSO4-
- Gốc axit HSO4- lại phân li ra H+
HSO4- 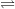 H+ + SO42-
H+ + SO42-
Hy vọng với lời giải bài 1 trang 10 SGK Hoá 11: Phát biểu các định nghĩa axit, axit một nấc và nhiều nấc, bazơ, hiđroxit lưỡng tính, muối trung hoà, muối axit?... ở trên đã giúp các em hiểu và nắm vững phần kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Hay Học Hỏi ghi nhận và hỗ trợ, chúc các em học tốt.
• Xem các bài tập Hoá 11 cùng chuyên mục
> Bài 3 trang 10 sgk hóa 11: Theo thuyết A-re-ni-ut, kết luận nào sau đây đúng?...
Đánh giá & nhận xét
-
 Bài 5 trang 91 SGK Hoá 11 Cánh diều
Bài 5 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 91 SGK Hoá 11 Cánh diều
Bài 4 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 91 SGK Hoá 11 Cánh diều: Nhận Biết Ethane, Ethylene, Acetylene
Bài 3 trang 91 SGK Hoá 11 Cánh diều: Nhận Biết Ethane, Ethylene, Acetylene
-
 Bài 2 trang 91 SGK Hoá 11 Cánh diều
Bài 2 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 91 SGK Hoá 11 Cánh diều
Bài 1 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 6 trang 99 SGK Hoá 11 Cánh diều
Bài 6 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 5 trang 99 SGK Hoá 11 Cánh diều
Bài 5 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 99 SGK Hoá 11 Cánh diều
Bài 4 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 99 SGK Hoá 11 Cánh diều
Bài 3 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 2 trang 99 SGK Hoá 11 Cánh diều
Bài 2 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 99 SGK Hoá 11 Cánh diều
Bài 1 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen & Nhiệt Hóa Học
Bài 3 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen & Nhiệt Hóa Học
-
 Bài 2 trang 106 SGK Hoá 11 Cánh diều
Bài 2 trang 106 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen
Bài 1 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen
-
 Bài 5 trang 71 SGK Hoá 11 Cánh diều
Bài 5 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 71 SGK Hoá 11 Cánh diều
Bài 4 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 71 SGK Hoá 11 Cánh diều
Bài 3 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 2 trang 71 SGK Hoá 11 Cánh diều
Bài 2 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 71 SGK Hoá 11 Cánh diều
Bài 1 trang 71 SGK Hoá 11 Cánh diều
-
 Giải bài 4 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 4 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 5 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 5 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 3 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 3 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 2 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 2 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 1 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 1 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 4 trang 50 Hóa 11 Cánh Diều SGK
Giải bài 4 trang 50 Hóa 11 Cánh Diều SGK
-
 Giải bài 3 trang 50 Hóa 11 Cánh Diều SGK
Giải bài 3 trang 50 Hóa 11 Cánh Diều SGK
-
 Giải bài 2 trang 50 Hóa 11 Cánh Diều SGK: Nguyên nhân hồ Kawah Ijen có môi trường acid
Giải bài 2 trang 50 Hóa 11 Cánh Diều SGK: Nguyên nhân hồ Kawah Ijen có môi trường acid
-
 Giải bài 1 trang 50 Hóa 11 Cánh Diều SGK
Giải bài 1 trang 50 Hóa 11 Cánh Diều SGK
-
 Bài 4 trang 50 SGK Hoá 11 Cánh diều
Bài 4 trang 50 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 50 SGK Hoá 11 Cánh diều
Bài 3 trang 50 SGK Hoá 11 Cánh diều
-
 Bài 2 trang 50 SGK Hoá 11 Cánh diều
Bài 2 trang 50 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 50 SGK Hoá 11 Cánh diều
Bài 1 trang 50 SGK Hoá 11 Cánh diều
-
 Giải bài 4 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 34 Hoá 11 SGK Chân trời sáng tạo


















































