Luyện tập tính chất của kim loại và bài tập vận dụng - hóa 12 bài 22
Kim loại có tính chất hóa học và tính chất vật lý như thế nào? đã được chúng ta tìm hiểu cụ thể và chi tiết qua các bài học trước.
Trong bài này, chúng ta sẽ cùng ôn tập lại một số nội dung chính về tính chất của kim loại, qua đó vận dụng làm các bài tập về tính chất của kim loại để các em nắm vững kiến thức.
I. KIẾN THỨC CẦN NHỚ VỀ TÍNH CHẤT CỦA KIM LOẠI
1. Cấu tạo của kim loại
a) Cấu tạo nguyên tử
- Nguyên tử của hầu hết các nguyên tố kim loại có số electron ở lớp ngoài cùng ít (1, 2, 3e).
b) Cấu tạo tinh thể
- Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút của mạng tinh thể. Các electron hóa trị chuyển động tự do trong mạng tinh thể.
c) Liên kết kim loại
- Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
2. Tính chất của kim loại
a) Tính chất vật lí chung:
- Các kim loại đều dẫn điện, dẫn nhiệt, dẻo, có ánh kim là do các electron tự do trong kim loại gây ra.
b) Tính chất hóa học chung:
– Các kim loại đều có tính khử: M → Mn+ + ne.
– Nguyên nhân: Các electron hóa trị của nguyên tử kim loại liên kết yếu với hạt nhân nguyên tử, do đó các kim loại có khả năng nhường electron để tạo thành ion dương.
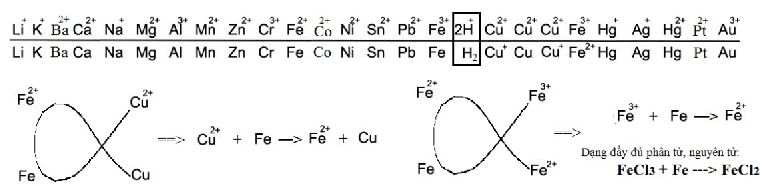
c) Dãy điện hóa của kim loại
- Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa 2 cặp oxi hóa – khử theo quy tắc ∝: Phản ứng giữa 2 cặp oxi hóa – khử xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
II. BÀI TẬP VỀ TÍNH CHẤT CỦA KIM LOẠI
Bài 1 trang 100 SGK Hóa 12: Có 4 ion là Ca2+, Al3+, Fe2+, Fe3+. Ion có số electron lớp ngoài cùng nhiều nhất là :
A. Fe3+. B. Fe2+. C. Al3+. D. Ca2+.
* Lời giải bài 1 trang 100 SGK Hóa 12:
- Đáp án: B. Fe2+
Bài 2 trang 100 SGK Hóa 12: Kim loại có tính chất vật lý chung là dẫn điện, dẫn nhiệt, dẻo và có ánh kim. Nguyên nhân của những tính chất vật lý chung là :
A. trong tinh thể kim loại có nhiều electron độc thân.
B. trong tinh thể kim loại có các ion dương chuyển động tự do.
C. trong tinh thể kim loại có các electron chuyển động tự do.
D. trong tinh thể kim loại có nhiều ion dương kim loại.
* Lời giải bài 2 trang 100 SGK Hóa 12:
- Đáp án: C. trong tinh thể kim loại có các electron chuyển động tự do.
Bài 3 trang 100 SGK Hóa 12: Kim loại khác nhau có độ dẫn điện, dẫn nhiệt khác nhau, sự khác nhau đó được quyết định bởi đặc điểm nào sau đây?
A. có khối lượng riêng khác nhau.
B. có kiểu mạng tinh thể khác nhau.
C. có mật độ electron tự do khác nhau.
D. có mật độ ion dương khác nhau.
* Lời giải Bài 3 trang 100 SGK Hóa 12:
- Đáp án: C.có mật độ electron tự do khác nhau.
Bài 4 trang 100 SGK Hóa 12: Ngâm một lá kim loại Ni trong những dung dịch muối sau: MgSO4, NaCl, CuSO4, AlCl3, ZnCl2, Pb(NO3)2, AgNO3. Hãy cho biết muối nào có phản ứng với Ni. Giải thích và viết phương trình hoá học.
* Lời giải bài 4 trang 100 SGK Hóa 12:
- Niken có thể phản ứng được với các dung dịch muối sau đây:
Ni + CuSO4 → NiSO4 + Cu↓
Ni + Pb(NO3)2 → Ni(NO3)2 + Pb↓
Ni + 2AgNO3 → Ni(NO3)2 + 2Ag↓
Bài 5 trang 101 SGK Hóa 12: Để làm sạch một mẫu thủy ngân có lẫn tạp chất là kẽm, thiếc, chì người ta khuấy mẫu thủy ngân này trong dung dịch HgSO4 dư.
a) Hãy giải thích phương pháp làm sạch và viết phương trình hóa học.
b) Nếu bạc có lẫn tạp chất là kim loại nói trên, hãy làm cách nào để loại bỏ được tạp chất? Viết phương trình hóa học.
* Lời giải bài 5 trang 101 SGK Hóa 12:
a) Khuấy mẫu thủy ngân trong dung dịch HgSO4 có các phản ứng
HgSO4 + Zn → ZnSO4 + Hg↓
HgSO4 + Sn → SnSO4 + Hg↓
HgSO4 + Pb → PbSO4 + Hg↓
- Như vậy các tạp chất Zn, Sn, Pb bị hòa tan hết. Lọc lấy kết tủa thu thủy ngân tinh khiết.
b) Nếu bạc có lẫn các kim loại nói trên cho hỗn hợp vào dung dịch AgNO3. Sẽ có các phản ứng xảy ra:
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag↓
Sn + 2AgNO3 → Sn(NO3)2 + 2Ag↓
Pb + 2AgNO3 → Pb(NO3)2 + 2Ag↓
- Khi đó các kim loại bị hòa tan hết trong dung dịch AgNO3 lọc lấy kết tủa thu được Ag tinh khiết
Bài 6 trang 101 SGK Hóa 12: Hòa tan hoàn toàn 20 gam hỗn hợp Fe và Mg trong dung dịch HCl thu 1 gam khí H2. Khi cô cạn dung dịch thu được bao nhiêu gam muối khan?
A. 54,5(g) B. 55,5(g) C. 56,5(g) D. 57,5(g)
* Lời giải bài 6 trang 101 SGK Hóa 12:
- Đáp án B.
• Cách giải 1:
- Gọi x, y lần lượt là số mol của Fe và Mg trong hỗn hợp
Theo bài ra, ta có: 56x + 24y = 20 (g) (1)
- Phương trình phản ứng:
Fe + 2HCl → FeCl2 + H2↑
x (mol) x x
Mg + 2HCl → MgCl2 + H2↑
y (mol) y y
- Theo bài ra, số mol H2 là: nH2 = 1/2 = 0,5 (mol)
- Theo PTPƯ: nH2 = x+ y = 0,5 (mol) (2)
⇒ Giải hệ PT (1) và (2) ta được, x = y = 0,25 (mol)
⇒ Khối lượng của muối: mmuối = mFeCl2 + mMgCl2 = 0,25.127+0,25.95 = 55,5 (g)
• Cách giải 2:
- Theo PTPƯ: nmuối = nH2 = 1/2 = 0,5 (mol)
⇒ Khối lượng muối: mmuối = m(kim loại) + m(gốc clorua) = 20,0 + 71. 0,5 = 55,5 (g)
Bài 7 trang 101 SGK Hóa 12: Hòa tan hoàn toàn 0,5 gam Fe và một kim loại hóa trị II trong dung dịch HCl thu được 1,12 lít khí H2 đktc. Kim loại hóa trị II đó là kim loại nào sau đây.
A. Mg. B. Ca. C. Zn. D. Be.
* Lời giải bài 7 trang 101 SGK Hóa 12:
- Đáp án: D. Be
- Gọi x, y lần lượt là số mol của Fe và M trong hỗn hợp
- Theo bài ra, ta có: 56x + My = 0,5 (g) (1)
Fe + 2HCl → FeCl2 + H2↑
x (mol) x x
M + 2HCl → MCl2 + H2↑
y (mol) y y
- Theo bài ra, số mol H2 là: nH2 = 1,12/22,4 = 0,05 (mol)
- Theo PTPƯ, ta có: nH2 = x + y = 0,05 (mol) (2)
Từ (2) ⇒ x= 0,05 – y, thay vào (1) ta được 56(0,05 – y) + My = 0,5
⇔ 2,8 – 56y + My = 0,5
⇔ 2,3 = 56y – My
⇒ y = 2,3/(56 - M)
Ta có 0 < y < 0,05
y > 0 ⇔ 2,3/(56-M) > 0 ⇒ 56 – M > 0 ⇒ M < 56
y < 0,05 ⇔ 2,3/(56-M) < 0,05 ⇒ 2,3 < 0,05(56 – M) ⇒ M < 10
⇒ Trong các kim loại hóa trị II chỉ có Be thỏa mãn do đó M là Be
Bài 8 trang 101 SGK Hóa 12: Cho 16,2 gam kim loại M có hóa trị n tác dụng với 0,15 mol O2. Chất rắn thu được sau phản ứng đem hòa tan vào dung dịch HCl dư thấy thoát ra 13,44 lít khí H2đktc. Kim loại M là kim loại nào sau đây?
A. Fe. B. Al. C. Ca. D. Mg.
* Lời giải bài 8 trang 101 SGK Hóa 12:
- Đáp án: B. Al
- Phương trình hoá học của phản ứng:
M + 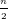 O2 → M2On (1)
O2 → M2On (1)
- Chất rắn sau phản ứng hòa tan trong HCl thấy có khí thoát ra chứng tỏ có M dư
M2On + 2HCl → 2MCln + H2O (2)
M + HCl → MCln + 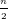 H2↑ (3)
H2↑ (3)
- Theo bài ra, số mol H2 là: nH2 = 13,44/22,4 = 0,6 (mol).
- Theo PTPƯ (1): nM = 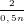 nO2=
nO2=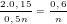
- Theo PTPƯ (3): nM = 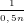 .nH2 =
.nH2 =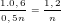
⇒ ∑nM = (0,6/n) + (1,2/n) = 1,8/n
⇒ M = 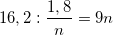
⇒ Giá trị thoả mãn là n = 3, M = 27 là Al
Bài 9 trang 101 SGK Hóa 12: Có 5 mẫu kim loại là Mg, Al, Ba, Fe, Ag. Nếu chỉ dùng thêm dung dịch H2SO4 thì có thể nhận biết được những mẫu kim loại nào ?
A. Mg, Ba, Ag.
B. Mg, Ba, Al.
C. Mg, Ba, Al, Fe.
D. Cả 5 mẫu kim loại.
* Lời giải bài 9 trang 101 SGK Hóa 12:
- Đáp án: D.
- Cho dd H2SO4 loãng lần vào các mẫu thử:
+ Mẫu có khí thoát ra có có kết tủa trắng là Ba
Ba + H2SO4 → BaSO4↓ + H2↑
+ Mẫu có khí thoát ra và dung dịch muối thu được có màu trắng xanh là Fe
Fe + H2SO4 → FeSO4 + H2↑
+ Mẫu không tan là Ag
+ 2 mẫu còn lại cùng có khí không màu thoát ra là Al và Mg
Mg + H2SO4 → MgSO4 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
- Lấy một lượng dư kim loại Ba (đã nhận biết được ở trên) nhỏ vài giot dd H2SO4 loãng đến sẽ xảy ra phản ứng
Ba + H2SO4 → BaSO4↓ + H2↑
Ba + 2H2O → Ba(OH)2 + H2↑
Lọc bỏ kết tủa BaSO4↓ ta thu được dd Ba(OH)2
- Cho Ba(OH)2 lần lượt vào 2 mẫu thử chưa nhận biết được là Mg và Al
+ Kim loại nào thấy khí thoát ra là Al
2Al + 2H2O + Ba(OH)2 → Ba(AlO2)2 + 2H2↑
+ Kim loại nào không có hiện tượng gì là Mg
⇒ Vậy sẽ nhận ra được cả 5 kim loại
Bài 10 trang 101 SGK Hóa 12: Cho bột đồng dư vào dung dịch hỗn hợp gồm Fe(NO3)3 và AgNO3 sau phản ứng kết thúc thu được chất rắn A và dung dịch B. Viết PTHH của các phản ứng xảy ra. Cho biết A, B gồm những chất gì? Biết rằng :
Tính oxi hóa : Ag+ > Fe3+ > Cu2+ > Fe2+
Tính khử : Cu > Fe2+ > Ag
* Lời giải bài 10 trang 101 SGK Hóa 12:
- Trường hợp Cu dư:
Cu + 2AgNO3 → Cu(NO3)2+ 2Ag↓
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
⇒ Rắn A gồm có: Ag, Cu dư
⇒ Dung dịch B gồm có: Cu(NO3)2, Fe(NO3)2
Hy vọng với bài viết hệ thống lại kiến thức về tính chất của kim loại và bài tập vận dụng ở trên hữu ích cho các em. Mọi thắc mắc và góp ý các em hãy để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
» Mục lục sách giáo khoa SGK Hóa học 12 Lý thuyết và Bài tập
Đánh giá & nhận xét
-
 Giải bài 4 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 4 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 54 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 54 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 54 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 54 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK


















































