Amin tính chất hoá học, công thức cấu tạo của Amin và bài tập - hoá 12 bài 9
Các Amin khác nhau thể hiện tính chất hoá học khác nhau, ví du như tính bazo của các Amin mạnh yếu khác nhau tuỳ vào vị trí của Nitơ gắn với gốc hidrocacbon đẩy e hay hút e, gốc không no hay gốc thơm.
Để hiểu rõ được tính chất hoá học, tính chất vật lý của các Amin chúng ta cùng tìm hiểu công thức cấu tạo của các Amin và vận dụng giải các bài tập về các amin qua bài viết dưới đây.
I. Amin - Định nghĩa, phân loại và danh pháp
1. Amin là gì?
- Amin là hợp chất hữu cơ được tạo ra khi thế một hoặc nhiều nguyên tử hiđro trong phân tử amoniac bằng một hoặc nhiều gốc hiđrocacbon.
Ví dụ: NH2 (amoniac) ; CH3-NH2 (metylamin) ; C6H5-NH2 (phenylamin) ; CH3-NH-CH3 (đimetylamin)
2. Phân loại Amin
- Amin được phân loại theo 2 cách thông dụng:
a) Theo đặc điểm cấu tạo của gốc hiđrocacbon
- Amin mạch hở: CH3NH2 , C2H5NH2 , ...
- Amin mạch vòng: C6H5NH2 , CH3C6H4NH2 , ...
b) Theo bậc của amin
- Bậc amin: là số nguyên tử H trong phân tử NH3 bị thay thế bởi gốc hiđrocacbon. Theo đó, các amin được phân loại thành: amin bậc 1, bậc 2, bậc 3.
- Công thức cấu tạo (bậc) của amin: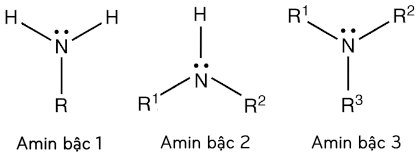
Ví dụ: CH3-CH2-CH2-NH2 (amin bậc 1) ; CH3-CH2-NH-CH3 (amin bậc 2) ; (CH3)3N (amin bậc 3).
- Công thức tổng quát của amin: CxHyNz (x, y, z ∈ N*; y ≤ 2x + 2 + z; y chẵn nếu z chẵn; y lẻ nếu z lẻ).
hoặc: CnH2n+2-2k+tNt (n ∈ N*; k ∈ N; t ∈ N*).
3. Cách gọi tên Amin - Danh pháp
a) Cách gọi tên theo danh pháp gốc – chức:
Tên amin = Gốc hiđrocacbon + amin
b) Cách gọi tên theo danh pháp thay thế :
Tên amin = Tên của hiđrocacbon tương ứng + Số thứ tự của C chứa nhóm NH2 + amin
c) Tên thông thường chỉ áp dụng với một số amin: Ví dụ: anilin C6H5NH2
II. Tính chất vật lý của Amin
- Các amin có khả năng tan tốt trong nước, do giữa amin và nước có liên kết Hiđro liên phân tử. Độ tan trong nước giảm khi số nguyên tử C tăng.
- Metyl–, đimetyl–, trimetyl– và etylaminlà những chất khí có mùi khai khó chịu, độc, dễ tan trong nước, các amin đồng đẳng cao hơn là chất lỏng hoặc rắn
- Anilin là chất lỏng, nhiệt độ sôi là 184oC, không màu, rất độc, ít tan trong nước, tan trong ancol và benzen
III. Cấu tạo phân tử, so sánh lực bazo của các Amin
1. Cấu trúc phân tử của amoniac và các amin
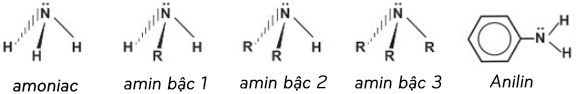
2. So sánh lực bazo giữa các amin
a) Các yếu tố ảnh hưởng đến lực bazơ của amin:
- Mật độ electron trên nguyên tử N: mật độ càng cao, lực bazơ càng mạnh và ngược lại.
- Hiệu ứng không gian: gốc R càng cồng kềnh và càng nhiều gốc R thì làm cho tính bazơ giảm đi, phụ thuộc vào gốc hiđrocacbon.
Ví dụ: Tính bazơ của (CH3)2NH > CH3NH2 > (CH3)3N ; (C2H5)2NH > (C2H5)3N > C2H5NH2
b) Phương pháp so sánh lực bazo giữa các amin
- Gốc đẩy electron làm tăng tính bazơ, gốc hút electron làm giảm tính bazơ.
Ví dụ: p-NO2-C6H4NH2 < C6H5NH2< NH3 < CH3NH2 < C2H5NH2 < C3H7NH2
- Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu. (Rthơm)3N < (R thơm)2NH < RthơmNH2 < NH3 < Rno NH2 < (Rno)2NH < (Rno)3N
- Nếu nguyên tử N trong phân tử amin gắn với các gốc hút e (gốc không no, gốc thơm) thì tính bazơ của amin yếu hơn so với tính bazơ của NH3. Những amin này không làm xanh quỳ tím.
- Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
IV. Tính chất hoá học của Amin
1. Tính bazơ của Amin
- Các phản ứng thể hiện tính bazơ
a) Amin tác dụng với dung dịch axit
CH3NH2 + H2SO4 → CH3NH3HSO4
2CH3NH2 + H2SO4 → (CH3NH3)2SO4
CH3NH2 + CH3COOH → CH3NH3OOCCH3
b) Amin tác dụng với dung dịch muối tạo bazơ không tan
2CH3NH2 + MgCl2 + 2H2O → Mg(OH)2 + 2CH3NH3Cl
3. Phản ứng nhận biết bậc của amin
- Nếu là amin bậc I khi phản ứng với HNO2 tạo khí thoát ra:
RNH2 + HNO2 → ROH + N2 + H2O
- Anilin phản ứng tạo muối điazoni ở 0 → 50C:
C6H5NH2 + HNO2 → C6H5N2+Cl- + 2H2O
- Nếu là amin bậc II thì tạo hợp chất nitrozo màu vàng nổi trên mặt nước:
RNHR’ + HNO2 → RN(NO)R’ + H2O
- Amin bậc III không có phản ứng này.
4. Phản ứng nâng bậc amin
RNH2 + R’I → RNHR’ + HI
RNHR’ + R’’I → RNR’R’’ + HI
5. Phản ứng riêng của Anilin
- Anilin là amin thơm nên không làm đổi màu quỳ tím thành xanh.
- Anilin tạo kết tủa trắng với dung dịch nước Brom:
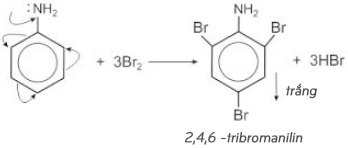 ⇒ Phản ứng này được dùng để nhận biết anilin.
⇒ Phản ứng này được dùng để nhận biết anilin.
V. Điều chế Amin
1. Hiđro hóa hợp chất nitro
C6H5NO2 + 6H → C6H5NH2 + 2H2O (Fe/HCl)
2. Dùng kiềm mạnh đẩy amin ra khỏi muối amoni
C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O
⇒ Phản ứng này dùng để tách anilin ra khỏi hỗn hợp.
3. Thay thế nguyên tử H của NH3 (phản ứng nâng bậc)
NH3 + RI → R - NH2 + HI
VI. Bài tập về Amin
Bài 1 trang 44 SGK hoá 12: Có 3 hóa chất sau đây: Etylamin, phenylamin, amoniac. Thứ tự tăng dần tính bazơ được xếp theo dãy:
A. Amoniac < etylamin < phenylamin.
B. Etylamin < amoniac < pheylamin.
C. Phenylamin < amoniac < etylamin.
D. Phenylamin < etyamin < amoniac.
>> Lời giải Bài 1 trang 44 SGK Hoá 12
Bài 2 trang 44 SGK hoá 12: Có thể nhận biết lọ đựng CH3NH2 bằng cách nào sau đây?
A. Nhận biết bằng mùi.
B. Thêm vài giọt dung dịch H2SO4.
C. Thêm vài giọt dung dịch Na2CO3.
D. Đưa đũa thủy tinh đã nhứng vào dung dịch HCl đậm đặc lên phía trên miệng lọ đựng dung dịch CH3NH2.
>> Lời giải Bài 2 trang 44 SGK Hoá 12
Bài 3 trang 44 SGK hoá 12: Viết công thức cấu tạo, gọi tên và chỉ rõ bậc từng amin có công thức phân tử sau:
a. C3H9N.
b. C7H9N. (có chứa vòng benzen)
>> Lời giải Bài 1 trang 44 SGK Hoá 12
Bài 4 trang 44 SGK hoá 12: Trình bày phương pháp hóa học hãy tách riêng từng chát trong mỗi hỗn hợp sau đây?
a. Hỗn hợp khí CH4 và CH3NH2.
b. Hỗn hợp lỏng : C6H6, C6H5OH và C6H5NH2.
>> Lời giải Bài 1 trang 44 SGK Hoá 12
Bài 5 trang 44 SGK hóa 12: Hãy tìm phương pháp hóa học để giải quyết hai vấn đề sau:
a. Rửa lọ đã đựng aniline
b. Khử mùi tanh của cá sau khi mổ để nấu. Biết rằng mùi tanh của cá, đặc biệt là của các mè do hỗn hợp một số amin (nhiều nhát là trimetylamin) và một số tạp chất khác gây nên.
>> Lời giải Bài 1 trang 44 SGK Hoá 12
Bài 6 trang 44 SGK hóa 12: a) Tính thể tích nước brom 3% (D=1,3g/ml) cần để điều chế 4,4 gam tribromanilin.
b) Tính khối lượng anilin có trong dung dịch A biết rằng khi cho tác dụng vào nước brom thì thu được 6,6 gam kết tủa trắng. Giả sử hiệu suất của cả hai trường hợp là 100%.
Hy vọng với bài viết về tính chất hoá học, công thức cấu tạo của Amin và bài tập vận dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
» Mục lục sách giáo khoa SGK Hóa học 12 Lý thuyết và Bài tập
Đánh giá & nhận xét

-
 Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 29 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 29 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 29 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 29 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 29 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 29 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 4 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 20 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 20 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 20 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 20 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 20 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 20 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 14 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 14 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 14 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 14 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 10 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 10 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 10 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 10 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 10 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 10 Hóa 12 Chân trời sáng tạo SGK
-
 Ôn tập chương 8: Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất? Hóa 12 bài 30 KNTT (Kết nối tri thức)
Ôn tập chương 8: Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất? Hóa 12 bài 30 KNTT (Kết nối tri thức)
-
 Tính chất và Ứng dụng của phức chất? Phản ứng tạo phức chất và phản ứng thế phối tử phức chất? Hóa 12 bài 29 KNTT
Tính chất và Ứng dụng của phức chất? Phản ứng tạo phức chất và phản ứng thế phối tử phức chất? Hóa 12 bài 29 KNTT
-
 Khái niệm phức chất? dạng hình học của phức chất và liên kết trong phức chất? Hóa 12 bài 28 KNTT
Khái niệm phức chất? dạng hình học của phức chất và liên kết trong phức chất? Hóa 12 bài 28 KNTT
-
 Đơn chất và hợp chất kim loại chuyển tiếp dãy thứ nhất, đặc điểm cấu tạo, tính chất vật lí? Hóa 12 bài 27 KNTT
Đơn chất và hợp chất kim loại chuyển tiếp dãy thứ nhất, đặc điểm cấu tạo, tính chất vật lí? Hóa 12 bài 27 KNTT
-
 Ôn tập chương 7: Pin điện và điện phân? Hóa 12 bài 26 KNTT (Kết nối tri thức)
Ôn tập chương 7: Pin điện và điện phân? Hóa 12 bài 26 KNTT (Kết nối tri thức)
-
 Nguyên tố nhóm IIA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IIA? Hóa 12 bài 25 KNTT
Nguyên tố nhóm IIA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IIA? Hóa 12 bài 25 KNTT
-
 Nguyên tố nhóm IA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IA? Hóa 12 bài 24 KNTT
Nguyên tố nhóm IA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IA? Hóa 12 bài 24 KNTT
-
 Ôn tập chương 6: Đại cương về Kim loại? Hóa 12 bài 23 KNTT (Kết nối tri thức)
Ôn tập chương 6: Đại cương về Kim loại? Hóa 12 bài 23 KNTT (Kết nối tri thức)


















































