Sự điện li của nước, nồng độ pH, Chất chỉ thị Axit Bazo và Bài tập - Hóa 11 bài 3
Trong bài học trước các em đã biết về chất điện li mạnh là chất khi tan trong nước các phân tử hòa tan đều phân li ra ion, còn chất điện li yếu thì chỉ có một số phần tử hòa tan phân li ra ion.
Vậy nước có phải là chất điện li hay không? sự điện li của nước là mạnh hay yếu? nồng độ pH là gì? chất chỉ thị màu axit bazơ có công dụng gì? chúng ta cùng tìm hiểu qua bài viết dưới đây.
I. Nước là chất điện li yếu
1. Sự điện li của nước
- Nước điện li rất yếu theo phương trình sau:
H2O 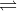 H+ + OH-
H+ + OH-
2. Tích số ion của nước
- Môi trường trung tính là môi trường có: [H+] = [OH-]
- Bằng thực nghiệm, ở 250C, người ta xác định được trong nước nguyên chất: [H+] = [OH-] = 1,0.10-7 M.
- Đặt: KH2O = [H+] . [OH-] = 1,0.10-7 . 1,0.10-7 = 1,0.10-14
- KH2O được gọi tích số ion của nước. Tích số này là hằng số ở nhiệt độ xác định (không khác nhiều với 250C). Một cách gần đúng, tích số này là cũng là hằng số cả trong những dung dịch loãng của các chất khác nhau.

3. Ý nghĩa tích số ion của nước
a) Môi trường axit
- Khi cho axit HCl vào nước, nồng độ H+ tăng, mà tích số ion trong nước không đổi nên nồng độ OH- phải giảm.
* Ví dụ: Tính [H+] và [OH-] của dung dịch HCl 10-3M.
° Lời giải:
- Ta có pt điện li:
HCl → H+ + Cl-
10-3M → 10-3M
⇒ [H+] = [HCl] = 10-3M. vì [H+].[OH-]=1,0.10-14 nên
⇒ ![small [OH^{-}]=frac{1,0.10^{-14}}{1,0.10^{-3}}=1,0.10^{-11}M](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/15778646327kvv78zqdr_1631141759.gif)
⇒ [H+]>[OH-] hay [H+] > 10-7M.
- Vậy môi trường axit là môi trường có: [H+]>[OH-] hay [H+]>1,0.10-7M
b) Môi trường kiềm
- Khi cho NaOH vào nước, nồng độ OH- tăng, mà tích số ion trong nước không đổi nên nồng độ H+ phải giảm.
* Ví dụ: Tính [H+] và [OH-] của dung dịch NaOH 10-5M.
° Lời giải:
- Ta có pt điện li:
NaOH → Na+ + OH-
10-5M → 10-5M
⇒ [OH-] = [NaOH] = 10-5M. vì [H+].[OH-]=1,0.10-14 nên
![small [H^{+}]=frac{1,0.10^{-14}}{1,0.10^{-5}}=1,0.10^{-9}M](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/1577864634izvzo41f3o_1631141759.gif)
⇒ [OH-]>[H+]
- Vậy môi trường kiềm là môi trường có: [H+]<[OH-] hay [H+]<1,0.10-7M
• Kết luận:
- Môi trường trung tính: [H+] = 1,0.10-7M
- Môi trường axit: [H+] < 1,0.10-7M
- Môi trường kiềm: [H+] > 1,0.10-7M
II. Khái niệm nồng độ pH, chất chỉ thị axit – bazơ
1. Khái niệm về nồng độ pH
- Có thể đánh giá độ axit và độ kiềm của dung dịch bằng nồng độ [H+].
- Để tránh ghi nồng độ [H+] với số mũ âm, người ta dùng gía trị pH với quy ước:
pH = - lg[H+] ; [H+] = 10- pHM.
Nếu [H+] = 10-aM thì pH = a.
* Ví dụ: [H+] = 1,0.10-5M ⇒ pH=5,00: môi trường axit
[H+] = 1,0.10-7M ⇒ pH=7,00: môi trường trung tính
[H+] = 1,0.10-9M ⇒ pH=9,00: môi trường kiềm
* Như vậy, ta có:
pH = 7: môi trường trung tính.
pH < 7: môi trường axit.
pH > 7: môi trường kiềm.
- Thang pH thường dùng có giá trị từ 1 đến 14.
2. Chất chỉ thị axit – bazơ
- Chất chỉ thị axit - bazơ là chất có màu biến đổi phụ thuộc theo giá trị pH của dung dịch.
 màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
- Khi trộn lẫn một số chất chỉ thị axit - bazơ có màu biến đổi kế tiếp nhau theo giá trị pH ta thu được chất chỉ thị vạn năng.
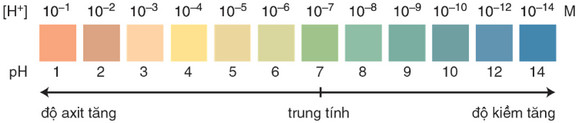 Màu của chất chỉ thị vạn năng (thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
Màu của chất chỉ thị vạn năng (thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
- Để xác định tương đối chính xác giá trị pH của dung dịch, người ta dùng máy đo pH.
III. Bài tập về sự điện li của nước ph chất chỉ thị axit bazơ
* Bài 1 trang 14 SGK Hóa 11: Tích số ion của nước là gì và bằng bao nhiêu ở 25oC?
>> Giải bài 1 trang 14 SGK Hóa 11
* Bài 2 trang 14 SGK Hóa 11: Phát biểu định nghĩa môi trường axit, trung tính và kiềm theo nồng độ H+ và pH?
>> Giải bài 2 trang 14 SGK Hóa 11
* Bài 3 trang 14 SGK Hóa 11: Chất chỉ thị axit - bazơ là gì? Hãy cho biết màu của quỳ tím và phenolphtalein trong các khoảng pH khác nhau?
>> Giải bài 3 trang 14 SGK Hóa 11
* Bài 4 trang 14 SGK Hóa 11: Một dung dịch có [OH- ]= 1,5.10-5. Môi trường của dung dịch này là:
A. Axit;
B. Trung tính;
C. Kiềm;
D. Không xác định được.
>> Giải bài 4 trang 14 SGK Hóa 11
* Bài 5 trang 14 SGK Hóa 11: Tính nồng độ H+, OH- và pH của dung dịch HCl 0,10M và dung dịch NaOH 0,010M?
* Bài 6 trang 14 SGK Hóa 11: Dung dịch HCl 0,010M, tích số ion của nước là:
A. [H+][OH- ] > 1,0.10-14 ;
B. [H+ ][OH- ] = 1,0.10-14;
C. [H+][OH- ] < 1,0.10-14 ;
D. Không xác định được
>> Giải bài 6 trang 14 SGK Hóa 11
Hy vọng với bài viết về sự điện ly của nước, pH và chất chỉ thị màu axit, bazo ở trên giúp các em nắm vững khối kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại dưới phần bình luận để HayHocHoi ghi nhận và hỗ trợ nhé. chúc các em học tốt.
|
¤ Các bài viết cùng chương 1: » Bài 4: Phản Ứng Trao Đổi Ion Trong Dung Dịch Các Chất Điện Li » Bài 5: Luyện Tập Axit, Bazơ Và Muối Và Phản Ứng Trao Đổi Ion Trong Dung Dịch Các Chất Điện Li » Bài 6: Bài Thực Hành 1: Tính Axit-Bazơ. Phản Ứng Trao Đổi Ion Trong Dung Dịch Các Chất Điện Li ¤ Có thể bạn muốn xem: |
Đánh giá & nhận xét


-
 Bài 5 trang 91 SGK Hoá 11 Cánh diều
Bài 5 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 91 SGK Hoá 11 Cánh diều
Bài 4 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 91 SGK Hoá 11 Cánh diều: Nhận Biết Ethane, Ethylene, Acetylene
Bài 3 trang 91 SGK Hoá 11 Cánh diều: Nhận Biết Ethane, Ethylene, Acetylene
-
 Bài 2 trang 91 SGK Hoá 11 Cánh diều
Bài 2 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 91 SGK Hoá 11 Cánh diều
Bài 1 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 6 trang 99 SGK Hoá 11 Cánh diều
Bài 6 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 5 trang 99 SGK Hoá 11 Cánh diều
Bài 5 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 99 SGK Hoá 11 Cánh diều
Bài 4 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 99 SGK Hoá 11 Cánh diều
Bài 3 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 2 trang 99 SGK Hoá 11 Cánh diều
Bài 2 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 99 SGK Hoá 11 Cánh diều
Bài 1 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen & Nhiệt Hóa Học
Bài 3 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen & Nhiệt Hóa Học
-
 Bài 2 trang 106 SGK Hoá 11 Cánh diều
Bài 2 trang 106 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen
Bài 1 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen
-
 Bài 5 trang 71 SGK Hoá 11 Cánh diều
Bài 5 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 71 SGK Hoá 11 Cánh diều
Bài 4 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 71 SGK Hoá 11 Cánh diều
Bài 3 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 2 trang 71 SGK Hoá 11 Cánh diều
Bài 2 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 71 SGK Hoá 11 Cánh diều
Bài 1 trang 71 SGK Hoá 11 Cánh diều
-
 Giải bài 4 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 4 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 5 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 5 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 3 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 3 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 2 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 2 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 1 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 1 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 4 trang 50 Hóa 11 Cánh Diều SGK
Giải bài 4 trang 50 Hóa 11 Cánh Diều SGK
-
 Giải bài 3 trang 50 Hóa 11 Cánh Diều SGK
Giải bài 3 trang 50 Hóa 11 Cánh Diều SGK
-
 Giải bài 2 trang 50 Hóa 11 Cánh Diều SGK: Nguyên nhân hồ Kawah Ijen có môi trường acid
Giải bài 2 trang 50 Hóa 11 Cánh Diều SGK: Nguyên nhân hồ Kawah Ijen có môi trường acid
-
 Giải bài 1 trang 50 Hóa 11 Cánh Diều SGK
Giải bài 1 trang 50 Hóa 11 Cánh Diều SGK
-
 Bài 4 trang 50 SGK Hoá 11 Cánh diều
Bài 4 trang 50 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 50 SGK Hoá 11 Cánh diều
Bài 3 trang 50 SGK Hoá 11 Cánh diều
-
 Bài 2 trang 50 SGK Hoá 11 Cánh diều
Bài 2 trang 50 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 50 SGK Hoá 11 Cánh diều
Bài 1 trang 50 SGK Hoá 11 Cánh diều
-
 Giải bài 4 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 34 Hoá 11 SGK Chân trời sáng tạo


















































