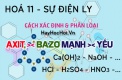
Điều kiện phản ứng trao đổi ion trong dung dịch các chất điện ly - hoá 11 bài 4
Phản ứng trao đổi ion trong dung dịch chất điện ly là một trong những phản ứng mà các em gặp khá nhiều bên cạnh các phản ứng như: phản ứng oxi hoá khử, phản ứng thế, phản ứng phân huỷ,...
Vậy phản ứng trao đổi ion trong dung dịch chất điện ly có gì khác với các phản ứng trên, trong bài viết này, chúng ta sẽ tìm hiểu về điều kiện để xảy ra phản ứng trao đổi ion trong dung dịch các chất điện ly, cùng các ví dụ và bài tập về phản ứng trao đổi ion. Qua đó, các em dễ dàng phân biệt được đâu là phản ứng trao đổi ion, đâu không phải là phản ứng trao đổi ion.
I. Phản ứng trao đổi ion là gì, các loại phản ứng trao đổi ion?
1. Phản ứng trao đổi ion là gì?
- Phản ứng trao đổi ion là phản ứng xảy ra khi các chất tham gia phản ứng trao đổi ion với nhau.
2. Các loại phản ứng trao đổi ion (nếu có):
• Muối + Axit → Muối mới + Axit mới
• Muối + Bazơ → Muối mới + Bazơ mới
• Muối + Muối → Muối mới + Muối mới
• Hidroxit không tan + Axit dung dịch → Muối dung dịch + H2O (chất điện li yếu)
• Axit dung dịch + Bazơ dung dịch → Muối dung dịch + H2O (chất điện li yếu)
II. Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch chất điện ly
- Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất 1 trong số các chất sau:
♦ Chất kết tủa.
♦ Chất điện li yếu.
♦ Chất khí.
1. Phản ứng trao đổi ion có sản phẩm tạo thành là chất kết tủa
Ví dụ 1: Na2SO4 + BaCl2 → BaSO4 ↓ trắng + 2NaCl
- Giải thích: Na2SO4 và BaCl2 đều dễ tan và phân ly mạnh trong nước.
Na2SO4 → 2Na+ + SO42-
BaCl2 → Ba2+ + 2Cl-
- Trong số 4 ion phân ly chỉ có các ion Ba2+ và SO42- kết hợp được với nhau tạo thành chất kết tủa là BaSO4, nên có thể viết phương trình ion thu gọn như sau:
Ba2+ + SO42- → BaSO4 ↓ trắng
Ví dụ 2: AgNO3 + HCl → AgCl↓ trắng + HNO3
Phương trình ion thu gọn: Ag+ + Cl- → AgCl↓ trắng

2. Phản ứng trao đổi ion có sản phẩm tạo thành là chất khí
Ví dụ 1: Na2CO3 + HCl → 2NaCl + CO2↑ + H2O
- Giải thích: Na2CO3 và HCl đều phân ly mạnh.
Na2CO3 → 2Na+ + CO32-
HCl → H+ + Cl-
- Ion H+ và CO32- kết hợp với nhau tạo thành H2CO3 axit này không bền phân huỷ thành CO2 + H2O.
- Phương trình ion rút gọn: 2H+ + CO32- → CO2↑ + H2O
Ví dụ 2: Na2S + HCl → 2NaCl + H2S↑
- Phương trình ion thu gọn: 2H+ + S2- → H2S↑
3. Phản ứng trao đổi ion có sản phẩm tạo thành là chất điện ly yếu
a) Phản ứng tạo thành nước
NaOH + HCl → NaCl + H2O
- Nước H2O là chất điện ly rất yếu, phương trình ion thu gọn:
H+ + OH- → H2O
b) Phản ứng tạo thành axit yếu
HCl + CH3COONa → CH3COOH + NaCl
- Axit axetic CH3COOH (mùi giấm) là axit điện ly yếu, phương trình ion thu gọn:
H+ + CH3COO- → CH3COOH
* Cách viết phương trình ion thu gọn:
◊ Bước 1: Chuyển tất cả chất vừa dễ tan vừa điện li mạnh thành ion, các chất kết tủa, điện li yếu để nguyên dưới dạng phân tử. Phương trình ion đầy đủ:
2Na+ + SO42- + Ba2+ + 2Cl- → BaSO4 + 2Na+ + 2Cl-
◊ Bước 2: Lược bỏ những ion không tham gia phản ứng:
SO42- + Ba2+ → BaSO4
4. Phản ứng axit - bazơ
- Phản ứng axit - bazơ là phản ứng trong đó có sự nhường và nhận proton (H+).
- Phản ứng axit - bazơ xảy ra theo chiều: Axit mạnh + Bazơ mạnh → Axit yếu hơn + Bazơ yếu hơn.
* Chú ý: Các trường hợp ngoại lệ
+ Tạo thành kết tủa khó tan phản ứng vẫn xảy ra được dù axit hoặc bazơ tạo thành mạnh hơn ban đầu.
CuSO4 + H2S → CuS + H2SO4 (CuS rất khó tan)
Pb(NO3)2 + H2S → PbS + 2HNO3 (PbS rất khó tan)
+ Axit khó bay hơi đẩy được axit dễ bay hơi (cả 2 axit đều mạnh):
H2SO4 đậm đặc + NaCl rắn ![small dpi{100} fn_cm small xrightarrow[]{<250^{0}C}](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/15531624906alzdz0lod_1631141504.gif) NaHSO4 + HCl
NaHSO4 + HCl
5. Thứ tự phản ứng axit - bazơ
a) Khi cho dung dịch chứa 1 axit vào dung dịch chứa nhiều bazơ
- Nguyên tắc: Các bazơ sẽ phản ứng theo thứ tự: axit + bazơ mạnh trước sau đó đến lượt axit + bazơ yếu (nếu axit nhiều thì có thể coi các bazơ phản ứng đồng thời).
- Một số ví dụ:
Ví dụ 1: Khi cho từ từ dung dịch HCl vào dung dịch chứa đồng thời chứa NaOH và NaAlO2:
HCl + NaOH → H2O + NaCl (ban đầu không thấy có hiện tượng kết tủa)
H2O + HCl + NaAlO2 → Al(OH)3 + NaCl (xuất hiện kết tủa và kết tủa tăng dần)
3HCl + Al(OH)3 → AlCl3 + 3H2O (kết tủa tan đến hết)
Ví dụ 2: Cho từ từ dung dịch chứa hỗn hợp NaOH và NaAlO2 vào dung dịch HCl: vì HCl nhiều nên chúng ta không quan sát thấy hiện tượng kết tủa:
HCl + NaOH → H2O + NaCl
4HCl + NaAlO2 → AlCl3 + NaCl + 2H2O
Ví dụ 3: Khi cho từ từ dung dịch chứa HCl vào dung dịch có chứa Na2CO3 và NaHCO3:
HCl + Na2CO3 → NaCl + NaHCO3 (không thấy có hiện tượng xuất hiện bọt khí)
HCl + NaHCO3 → NaCl + CO2 + H2O (có khí thoát ra)
Ví dụ 4: Cho từ từ dung dịch chứa NaHCO3 và Na2CO3 vào dung dịch HCl: ngay lập tức quan sát thấy hiện tượng có khí thoát ra:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
b) Khi cho dung dịch chứa 1 bazơ vào dung dịch có chứa nhiều axit
- Nguyên tắc: Các axit sẽ phản ứng theo thứ tự từ mạnh đến yếu. Nếu bazơ nhiều thì coi các phản ứng xảy ra đồng thời.
Ví dụ 1: Cho từ từ dung dịch NaOH vào dung dịch chứa đồng thời cả HCl và AlCl3:
NaOH + HCl → NaCl + H2O (không có kết tủa xuất hiện)
3NaOH + AlCl3 → Al(OH)3 + 3NaCl (có kết tủa xuất hiện và kết tủa tăng dần)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (kết tủa tan đến hết)
Ví dụ 2: Cho từ từ dung dịch chứa HCl và AlCl3 vào dung dịch có chứa NaOH:
HCl + NaOH → NaCl + H2O
AlCl3 + 4NaOH → NaAlO2 + 3NaCl + 2H2O (không thấy có kết tủa)
III. Bài tập luyện tập phản ứng trao đổi ion trong dung dịch
* Bài 1 trang 20 SGK Hóa 11: Điều kiện để xảy ra phản ứng trao đổi ion trong dung dịch chất điện li là gì? Lấy các ví dụ minh hoạ?
> Lời giải bài 1 trang 20 SGK Hóa 11
* Bài 2 trang 20 SGK Hóa 11: Tại sao các phản ứng giữa dung dịch axit và hiđroxit có tính bazơ và phản ứng với muối cacbonat và dung dịch axit rất dễ xảy ra?
> Lời giải bài 2 trang 20 SGK Hóa 11
* Bài 3 trang 20 SGK Hóa 11: Lấy một số thí dụ chứng minh: bản chất của phản ứng trong dung dich điện li là phản ứng giữa các ion?
> Lời giải bài 3 trang 20 SGK Hóa 11
* Bài 4 trang 20 SGK Hóa 11: Phương trình ion rút gọn của phản ứng cho biết:
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch là lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
> Lời giải bài 4 trang 20 SGK Hóa 11
* Bài 5 trang 20 SGK Hóa 11: Viết phương trình phân tử và phương trình ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch giữa các cặp chất sau:
a) Fe2(SO4)3 + NaOH
b) NH4Cl + AgNO3
c) NaF + HCl
d) MgCl2 + KNO3
e) FeS (r) + 2HCl
g) HClO + KOH
> Lời giải bài 5 trang 20 SGK Hóa 11
* Bài 6 trang 20 SGK Hóa 11: Phản ứng nào dưới đây xảy ra trong dung dịch tạo được kết tủa Fe(OH)3?
A. FeSO4 + KMnO4 + H2SO4
B. Fe2(SO4)3 + KI
C. Fe(NO3)3 + Fe
D. Fe(NO3)3 + KOH
> Lời giải bài 6 trang 20 SGK Hóa 11
* Bài 7 trang 20 SGK Hóa 11: Lấy thí dụ và viết các phương trình hoá học dưới dạng phân tử và ion rút gọn cho phản ứng sau:
a) Tạo thành chất kết tủa
b) Tạo thành chất điện li yếu
c) Tạo thành chất khí
Hy vọng với bài viết về điều kiện xảy ra phản ứng trao đổi ion trong dung dịch chất điện ly cùng ví dụ và bài tập về phản ứng trao đổi ion ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
|
¤ Các bài viết cùng chương 1: » Bài 3: Sự Điện Li Của Nước – pH Và Chất Chỉ Thị Axit – Bazơ » Bài 5: Luyện Tập Axit, Bazơ Và Muối Và Phản Ứng Trao Đổi Ion Trong Dung Dịch Các Chất Điện Li » Bài 6: Bài Thực Hành 1: Tính Axit-Bazơ. Phản Ứng Trao Đổi Ion Trong Dung Dịch Các Chất Điện Li ¤ Có thể bạn muốn xem: |
Đánh giá & nhận xét


-
 Ôn tập chương 6: Hợp chất Carbonyl, Carboxylic acid? Hóa 11 bài 25 KNTT (Kết nối tri thức)
Ôn tập chương 6: Hợp chất Carbonyl, Carboxylic acid? Hóa 11 bài 25 KNTT (Kết nối tri thức)
-
 Tính chất hóa học, tính chất vật lí Carboxylic Acid? Cấu tạo, điều chế và ứng dụng Carboxylic Acid? Hóa 11 bài 24 KNTT
Tính chất hóa học, tính chất vật lí Carboxylic Acid? Cấu tạo, điều chế và ứng dụng Carboxylic Acid? Hóa 11 bài 24 KNTT
-
 Tính chất hóa học, tính chất vật lí Carbonyl? Khái niệm, cấu tạo, điều chế và ứng dụng Carbonyl? Hóa 11 bài 23 KNTT
Tính chất hóa học, tính chất vật lí Carbonyl? Khái niệm, cấu tạo, điều chế và ứng dụng Carbonyl? Hóa 11 bài 23 KNTT
-
 Ôn tập chương 5: Dẫn xuất halogen, Alcohol, Phenol? Hóa 11 bài 22 KNTT (Kết nối tri thức)
Ôn tập chương 5: Dẫn xuất halogen, Alcohol, Phenol? Hóa 11 bài 22 KNTT (Kết nối tri thức)
-
 Tính chất hóa học Phenol, tính chất vật lí Phenol? Khái niệm, cấu tạo, điều chế và ứng dụng Phenol? Hóa 11 bài 21 KNTT
Tính chất hóa học Phenol, tính chất vật lí Phenol? Khái niệm, cấu tạo, điều chế và ứng dụng Phenol? Hóa 11 bài 21 KNTT
-
 Tính chất hóa học Alcohol, tính chất vật lí Alcohol? Khái niệm, cấu tạo, điều chế và ứng dụng Alcohol? Hóa 11 bài 20 KNTT
Tính chất hóa học Alcohol, tính chất vật lí Alcohol? Khái niệm, cấu tạo, điều chế và ứng dụng Alcohol? Hóa 11 bài 20 KNTT
-
 Tính chất hóa học tính chất vật lí Halogen? Khái niệm, đặc điểm cấu tạo và ứng dụng Halogen? Hóa 11 bài 19 KNTT
Tính chất hóa học tính chất vật lí Halogen? Khái niệm, đặc điểm cấu tạo và ứng dụng Halogen? Hóa 11 bài 19 KNTT
-
 Ôn tập chương 4: Hydrocarbon? Hóa 11 bài 18 KNTT (Kết nối tri thức)
Ôn tập chương 4: Hydrocarbon? Hóa 11 bài 18 KNTT (Kết nối tri thức)
-
 Tính chất hóa học Arene, tính chất vật lí Arene? Công thức cấu tạo, điều chế và ứng dụng Arene? Hóa 11 bài 17 KNTT
Tính chất hóa học Arene, tính chất vật lí Arene? Công thức cấu tạo, điều chế và ứng dụng Arene? Hóa 11 bài 17 KNTT
-
 Tính chất hóa học tính chất vật lí Alkene, Alkyne? Cấu tạo, điều chế và ứng dụng Alkene Alkyne? Hóa 11 bài 16 KNTT
Tính chất hóa học tính chất vật lí Alkene, Alkyne? Cấu tạo, điều chế và ứng dụng Alkene Alkyne? Hóa 11 bài 16 KNTT
-
 Tính chất hóa học Alkane, tính chất vật lí Alkane, khái niệm, cấu tạo, ứng dụng và điều chế Alkane? Hóa 11 bài 15 KNTT
Tính chất hóa học Alkane, tính chất vật lí Alkane, khái niệm, cấu tạo, ứng dụng và điều chế Alkane? Hóa 11 bài 15 KNTT
-
 Khái niệm Công thức cấu tạo, đồng đẳng đồng phân hợp chất hữu cơ? thuyết cấu tạo hóa học? Hóa 11 bài 14 KNTT
Khái niệm Công thức cấu tạo, đồng đẳng đồng phân hợp chất hữu cơ? thuyết cấu tạo hóa học? Hóa 11 bài 14 KNTT
-
 Khái niệm Công thức cấu tạo, đồng đẳng đồng phân hợp chất hữu cơ? thuyết cấu tạo hóa học? Hóa 11 bài 13 KNTT
Khái niệm Công thức cấu tạo, đồng đẳng đồng phân hợp chất hữu cơ? thuyết cấu tạo hóa học? Hóa 11 bài 13 KNTT
-
 Lập Công thức phân tử hợp chất hữu cơ? Khái niệm, cách biểu diễn CTPT hợp chất hữu cơ? Hóa 11 bài 12 KNTT
Lập Công thức phân tử hợp chất hữu cơ? Khái niệm, cách biểu diễn CTPT hợp chất hữu cơ? Hóa 11 bài 12 KNTT
-
 Các phương pháp tách và tinh chế hợp chất hữu cơ: Chưng cất, chiết, kết tinh, sắc kí cột? Hóa 11 bài 11 KNTT
Các phương pháp tách và tinh chế hợp chất hữu cơ: Chưng cất, chiết, kết tinh, sắc kí cột? Hóa 11 bài 11 KNTT
-
 Hợp chất hữu cơ là gì? đặc điểm, cách phân loại hợp chất hữu cơ? Khái niệm nhóm chức là gì? Hóa 11 bài 10 KNTT
Hợp chất hữu cơ là gì? đặc điểm, cách phân loại hợp chất hữu cơ? Khái niệm nhóm chức là gì? Hóa 11 bài 10 KNTT
-
 Ôn tập chương 2: Nitrogen-Sulfur? Hóa 11 bài 9 KNTT (Kết nối tri thức)
Ôn tập chương 2: Nitrogen-Sulfur? Hóa 11 bài 9 KNTT (Kết nối tri thức)
-
 Tính chất hóa học, vật lí của Sulfuric Acid H2SO4, cấu tạo phân tử và ứng dụng của muối Sulfate? Hóa 11 bài 8 KNTT
Tính chất hóa học, vật lí của Sulfuric Acid H2SO4, cấu tạo phân tử và ứng dụng của muối Sulfate? Hóa 11 bài 8 KNTT
-
 Tính chất hóa học, vật lí của Sulfur (S), Sulfur dioxide (SO2)? Cấu tạo sulfur, ứng dụng sulfur dioxide? Hóa 11 bài 7 KNTT
Tính chất hóa học, vật lí của Sulfur (S), Sulfur dioxide (SO2)? Cấu tạo sulfur, ứng dụng sulfur dioxide? Hóa 11 bài 7 KNTT
-
 Tính chất hóa học, vật lí của Acid Nitric? Các oxide của nitrogen, công thức, tên gọi, mưa acid? Hóa 11 bài 6 KNTT
Tính chất hóa học, vật lí của Acid Nitric? Các oxide của nitrogen, công thức, tên gọi, mưa acid? Hóa 11 bài 6 KNTT
-
 Tính chất hóa học của Ammonia NH3, muối Ammonium? Cấu tạo phân tử, tính chất vật lí Ammonia và ứng dụng? Hóa 11 bài 5 KNTT
Tính chất hóa học của Ammonia NH3, muối Ammonium? Cấu tạo phân tử, tính chất vật lí Ammonia và ứng dụng? Hóa 11 bài 5 KNTT
-
 Tính chất hóa học của Nitrogen (N2)? Tính chất vật lí, cấu tạo phân tử và ứng dụng Nitrogen? Hóa 11 bài 4 KNTT
Tính chất hóa học của Nitrogen (N2)? Tính chất vật lí, cấu tạo phân tử và ứng dụng Nitrogen? Hóa 11 bài 4 KNTT
-
 Ôn tập chương 1: Cân bằng hóa học? Hóa 11 bài 3 KNTT (Kết nối tri thức)
Ôn tập chương 1: Cân bằng hóa học? Hóa 11 bài 3 KNTT (Kết nối tri thức)
-
 Thuyết Acid Base của Bronsted Lowry, khái niệm Acid-Base, pH và ý nghĩa của pH trong thực tiễn? Hóa 11 bài 2 KNTT
Thuyết Acid Base của Bronsted Lowry, khái niệm Acid-Base, pH và ý nghĩa của pH trong thực tiễn? Hóa 11 bài 2 KNTT
-
 Phản ứng một chiều, phản ứng thuận nghịch là gì? hằng số cân bằng hóa học, các yếu tố ảnh hưởng? Hóa 11 bài 1 KNTT
Phản ứng một chiều, phản ứng thuận nghịch là gì? hằng số cân bằng hóa học, các yếu tố ảnh hưởng? Hóa 11 bài 1 KNTT
-
 Mục lục SGK Hóa 11 Kết nối tri thức - Lý thuyết và bài tập Hóa 11 SGK Kết nối tri thức
Mục lục SGK Hóa 11 Kết nối tri thức - Lý thuyết và bài tập Hóa 11 SGK Kết nối tri thức
-
 Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
-
 Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
-
 Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
-
 Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
-
 Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
-
 Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
-
 Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
-
 Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
-
 Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
-
 Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
-
 Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
-
 Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
-
 Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7
Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7