Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7
Lý thuyết Bài 7: Sulfuric acid và muối Sulfate chương 2 Hoá 11 Chân trời sáng tạo.
Nội dung về Tính chất vật lí, cấu tạo phân tử, tính chất hoá học của Sulfuric acid (H2SO4), quy trình sản xuất Sulfuric acid theo phương pháp tiếp xúc và ứng dụng của muối sulfate.
1. Sulfuric acid (H2SO4) tính chất vật lí, cấu tạo phân tử, tính chất hoá học của sulfuric acid
1.1. Tính chất vật lí của sulfuric acid H2SO4
• Sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp hai lần nước (98% có khối lượng riêng là 1,84 g/cm3).
1.2. Cấu tạo phân tử của sulfuric acid H2SO4
• Sulfuric acid có cấu tạo phân tử như sau:
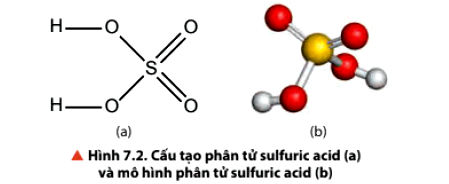
1.3. Tính chất hoá học của sulfuric acid H2SO4
• Dung dịch sulfuric acid loãng là một trong các acid mạnh và có tính chất chung của acid như làm quỳ tím hoá đỏ, tác dụng với kim loại, base, muối,…
• Dung dịch sulfuric acid đặc có tính oxi hoá mạnh và tính háo nước.
Cu + H2SO4 (đặc) CuSO4 + SO2 + H2O
C12H22O11 + H2SO4 (đặc) → 12C + H2SO4.11H2O
(Saccharose)
C + 2H2SO4 (đặc) → CO2 + 2SO2 + 2H2O
• Sulfuric acid là hoá chất hàng đầu được dùng trong nhiều ngành sản xuất: Sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hoá học, chất dẻo, sơn màu,…
1.4. Cách bảo quản, sử dụng và nguyên tắc xử lí sơ bộ khi bỏng acid
• Khi sử dụng, bảo quản dung dịch sulfuric acid cần phải cẩn thận, tuân thử đúng nguyên tắc an toàn.
- Cần bảo quản sulfuric acid trong các bình kín và đặt ở nơi khô ráo, thoáng mát; không đặt gần nơi có các chất khử, kim loại nhẹ.
- Pha loãng dung dịch H2SO4 đặc: Rót từ từ dung dịch H2SO4 đặc vào nước và khuấy đều. Tuyệt đối không làm ngược lại, sẽ rất nguy hiểm.
• Cần nắm vững và thực hiện đúng các nguyên tắc xử lí sơ bộ khi bị bỏng acid: Khi bị bỏng aicd, cần nhanh chóng bỏ quần áo bị dính acid, sau đó rửa ngay bằng nước sạch khoảng 20 phút. Sau đó, cần nhanh chóng chuyển người bị bỏng đến cơ sở y tế gần nhất để được theo dõi và điều trị.
1.5. Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc:
• Giai đoạn 1: Sản xuất sulfur dioxide (SO2)
4FeS2 + 11O2 2Fe2O3 + 8SO2
S + O2 SO2
• Giai đoạn 2: Sản xuất sulfur trioxide (SO3)
2SO2(g) + O2(g) → 2SO3(g) (450 - 5000C, V2O5) ΔrH2980 = –198kJ
• Giai đoạn 3: Sản xuất sulfuric acid (H2SO4)
Dung dịch H2SO4 98% hấp thụ SO3, thu được Oleum.
H2SO4 + nSO3 → H2SO4.nSO3 (Oleum)
Sau đó dùng lượng nước thích hợp pha loãng Oleum thu được dung dịch H2SO4 đặc.
H2SO4.nSO3 + nH2O → (n+1)H2SO4
2. Muối sulfate
- Muối sulfate là những hợp chất quan trọng, được ứng dụng trong nhiều ngành công nghiệp. Ví dụ: CaSO4 làm vật liệu xây dựng, làm chất phụ gia; MgSO4 được sử dụng sản xuất muối tắm, (NH4)2SO4 là thành phần của thuốc trừ sâu hoà tan, thuốc diệt nấm,…
- Thuốc thử để nhận biết ion sulfate SO42– (trong dung dịch H2SO4 hoặc trong dung dịch muối sulfate) là ion Ba2+ (trong dung dịch barium hoặc dung dịch Ba(OH)2).
Ba2+ + SO42– → BaSO4↓ (trắng).
Với nội dung bài viết về: Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7 chi tiết, dễ hiểu ở trên. Hay Học Hỏi hy vọng giúp các em nắm vững nội dung Lý thuyết Hoá 11 Chân trời sáng tạo. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để được ghi nhận và hỗ trợ, chúc các em học tốt.
> Xem thêm Lý thuyết Hóa 11 Chân trời sáng tạo
Lý thuyết Hóa 11 Bài 5: Một số hợp chất với oxygen của nitrogen
Lý thuyết Hóa 11 Bài 6: Sulfur và sulfur dioxide
Lý thuyết Hóa 11 Bài 8: Hợp chất hữu cơ và hóa học hữu cơ
Lý thuyết Hóa 11 Bài 9: Phương pháp tách và tinh chế hợp chất hữu cơ
Lý thuyết Hóa 11 Bài 10: Công thức phân tử hợp chất hữu cơ
Đánh giá & nhận xét
-
 Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
-
 Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
-
 Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
-
 Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
-
 Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
-
 Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
-
 Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
-
 Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
-
 Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
-
 Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
-
 Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
-
 Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
-
 Tính chất vật lí, tính chất hoá học của Sulfur (S), Sulfur dioxide (SO2) và ứng dụng? Hoá 11 chân trời bài 6
Tính chất vật lí, tính chất hoá học của Sulfur (S), Sulfur dioxide (SO2) và ứng dụng? Hoá 11 chân trời bài 6
-
 Tính chất vật lí, tính chất hoá học của Nitric Acid HNO3, hợp chất Oxide của Nitrogen? Hoá 11 chân trời bài 5
Tính chất vật lí, tính chất hoá học của Nitric Acid HNO3, hợp chất Oxide của Nitrogen? Hoá 11 chân trời bài 5
-
 Tính chất vật lí, tính chất hoá học của Ammonia (NH3), Ammonium và ứng dụng? Hoá 11 chân trời bài 4
Tính chất vật lí, tính chất hoá học của Ammonia (NH3), Ammonium và ứng dụng? Hoá 11 chân trời bài 4
-
 Nitrogen tính chất vật lí, tính chất hoá học của Nitrogen và ứng dụng? Hoá 11 chân trời bài 3
Nitrogen tính chất vật lí, tính chất hoá học của Nitrogen và ứng dụng? Hoá 11 chân trời bài 3
-
 Cân bằng trong dung dịch nước, thuyết Bronsted Lowry về Acid, Base, Khái niệm pH? Hoá 11 chân trời bài 2
Cân bằng trong dung dịch nước, thuyết Bronsted Lowry về Acid, Base, Khái niệm pH? Hoá 11 chân trời bài 2
-
 Cân bằng hoá học là gì, hằng số cân bằng của phản ứng và sự dịch chuyển của cân bằng? Hoá 11 chân trời bài 1
Cân bằng hoá học là gì, hằng số cân bằng của phản ứng và sự dịch chuyển của cân bằng? Hoá 11 chân trời bài 1
-
 Mục lục SGK Hóa 11 Chân trời sáng tạo - Lý thuyết và bài tập Hóa 11 SGK Chân trời sáng tạo
Mục lục SGK Hóa 11 Chân trời sáng tạo - Lý thuyết và bài tập Hóa 11 SGK Chân trời sáng tạo


















































