Tính chất vật lí, tính chất hoá học của Ammonia (NH3), Ammonium và ứng dụng? Hoá 11 chân trời bài 4
Lý thuyết Bài 4: Ammonia và một số hợp chất Ammonium chương 2 Hoá 11 Chân trời sáng tạo.
Nội dung về Cấu tạo phân tử của Ammonia (NH3), tính chất vật lí, tính chất hoá học của Amonia, cách tổng hợp ammonia. Tính chất vật lí, tính chất hoá học của muối Ammonium. Ứng dụng của Ammonia và Ammonium.
1. Cấu tạo phân tử của Ammonia NH3
• Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen.
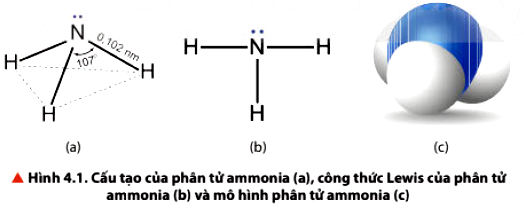
2. Tính chất vật lí, tính chất hoá học của Ammonia NH3
2.1. Tính chất vật lí của Amonia
Ammonia là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí. Ammonia tan rất nhiều trong nước tạo thành dung dịch ammonia. Dung dịch ammonia đậm đặc thường có nồng độ 25%.
2.2. Tính chất hoá học của Ammonia
Ammonia chủ yếu thể hiện tính khử và tính base trong các phản ứng hoá học.
- Ammonia thể hiện tính base:
NH3 + H2O NH4+ + OH–
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4
- Ammonia thể hiện tính khử:
4NH3 + 3O2 2N2 + 6H2O
4NH3 + 5O2 4NO+ 6H2O
3. Tổng hợp ammonia NH3
Quá trình Haber được thể hiện như sau:
- Hỗn hợp nitrogen và hydrogen (tỉ lệ mol 1 : 3) được nén ở áp suất cao và đưa vào tháp tổng hợp ammonia trong điều kiện nhiệt độ, áp suất và chất xúc tác thích hợp.
N2(g) + 3H2(g) 2NH3(g) ΔrH2980 = –91,8 kJ
Trên thực tế, phản ứng này thường được thực hiện ở nhiệt độ khoảng 3800C – 4500C áp suất khoảng 25 - 200 bar và dùng chất xúc tác là Fe.
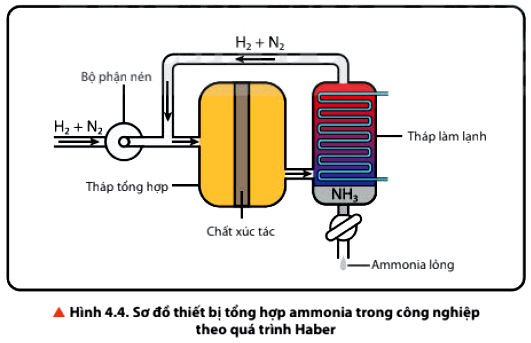
- Hỗn hợp khí đi ra từ tháp tổng hợp gồm N2, H2 và NH3 được dẫn đến tháp làm lạnh. Ở đây, NH3 hoá lỏng và được tách riêng, còn hỗn hợp khí N2 và H2 chưa phản ứng được đưa trở lại tháp tổng hợp.
4. Muối ammonium
4.1. Tính chất vật lí của ammonium
Muối ammonium là những chất tinh thể ion. Hầu hết các muối ammonium dễ tan trong nước.
4.2. Tính chất hoá học của ammonium
- Muối ammonium tác dụng với dung dịch kiềm khi đun nóng cho khi ammonia có mùi xốc đặc trưng. Phản ứng này dùng để nhận biết ion ammonium trong dung dịch.
NH4+ + OH– → NH3↑ + H2O
- Muối ammonium dễ bị phân huỷ khi đun nóng.
NH4Cl NH3 + HCl
NH4HCO3 NH3 + CO2 + H2O
NH4NO3 N2O + 2H2O
5. Ứng dụng của Ammonia và Ammonium
• Ứng dụng của Ammonia
- Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất.
• Ứng dụng của Ammonium
- Muối ammonium được sử dụng rộng rãi trong đời sống và sản xuất, đặc biệt được dùng làm phân bón trong nông nghiệp.
Với nội dung bài viết về: Tính chất vật lí, tính chất hoá học của Ammonia, Ammonium và ứng dụng? Hoá 11 chân trời bài 4 chi tiết, dễ hiểu ở trên. Hay Học Hỏi hy vọng giúp các em nắm vững nội dung Lý thuyết Hoá 11 Chân trời sáng tạo. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để được ghi nhận và hỗ trợ, chúc các em học tốt.
> Xem thêm Lý thuyết Hóa 11 Chân trời sáng tạo
Lý thuyết Hóa 11 Bài 1: Khái niệm về cân bằng hóa học
Lý thuyết Hóa 11 Bài 2: Cân bằng trong dung dịch nước
Lý thuyết Hóa 11 Bài 3: Đơn chất nitrogen
Lý thuyết Hóa 11 Bài 5: Một số hợp chất với oxygen của nitrogen
Lý thuyết Hóa 11 Bài 6: Sulfur và sulfur dioxide
Đánh giá & nhận xét
-
 Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
-
 Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
-
 Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
-
 Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
-
 Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
-
 Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
-
 Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
-
 Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
-
 Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
-
 Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
-
 Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
-
 Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
-
 Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7
Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7
-
 Tính chất vật lí, tính chất hoá học của Sulfur (S), Sulfur dioxide (SO2) và ứng dụng? Hoá 11 chân trời bài 6
Tính chất vật lí, tính chất hoá học của Sulfur (S), Sulfur dioxide (SO2) và ứng dụng? Hoá 11 chân trời bài 6
-
 Tính chất vật lí, tính chất hoá học của Nitric Acid HNO3, hợp chất Oxide của Nitrogen? Hoá 11 chân trời bài 5
Tính chất vật lí, tính chất hoá học của Nitric Acid HNO3, hợp chất Oxide của Nitrogen? Hoá 11 chân trời bài 5
-
 Nitrogen tính chất vật lí, tính chất hoá học của Nitrogen và ứng dụng? Hoá 11 chân trời bài 3
Nitrogen tính chất vật lí, tính chất hoá học của Nitrogen và ứng dụng? Hoá 11 chân trời bài 3
-
 Cân bằng trong dung dịch nước, thuyết Bronsted Lowry về Acid, Base, Khái niệm pH? Hoá 11 chân trời bài 2
Cân bằng trong dung dịch nước, thuyết Bronsted Lowry về Acid, Base, Khái niệm pH? Hoá 11 chân trời bài 2
-
 Cân bằng hoá học là gì, hằng số cân bằng của phản ứng và sự dịch chuyển của cân bằng? Hoá 11 chân trời bài 1
Cân bằng hoá học là gì, hằng số cân bằng của phản ứng và sự dịch chuyển của cân bằng? Hoá 11 chân trời bài 1
-
 Mục lục SGK Hóa 11 Chân trời sáng tạo - Lý thuyết và bài tập Hóa 11 SGK Chân trời sáng tạo
Mục lục SGK Hóa 11 Chân trời sáng tạo - Lý thuyết và bài tập Hóa 11 SGK Chân trời sáng tạo


















































