Cân bằng hoá học là gì, hằng số cân bằng của phản ứng và sự dịch chuyển của cân bằng? Hoá 11 chân trời bài 1
Lý thuyết Bài 1: Cân bằng Hoá học, Khái niệm cân bằng hoá học chương 1 Hoá 11 Chân trời sáng tạo. Nội dung về Cân bằng hoá học, hằng số cân bằng của phản ứng thuận nghịch, sự dịch chuyển cân bằng hoá học và các yếu tố ảnh hưởng tới cân bằng hoá học.
Khái niệm cân bằng hoá học là gì, phản ứng thuận nghịch là gì, hằng số cân bằng của phản ứng và các yếu tố ảnh hưởng đến cân bằng hoá học là gì? câu trả lời sẽ có ngay trong nội dung bài viết này.
1. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hoá học
1.1. Phản ứng một chiều
Trong điều kiện xác định, phản ứng chỉ xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không thể tác dụng với nhau để tạo lại chất ban đầu, gọi là phản ứng một chiều.
- Trong phương trình hoá học của phản ứng một chiều, người ta dùng kí hiệu mũi tên (→) chỉ chiều phản ứng.
* Ví dụ: 2KmnO4 K2MnO4 + MnO2 + O2
1.2. Phản ứng thuận nghịch
- Trong cùng điều kiện xác định, phản ứng xảy ra theo hai chiều trái ngược nhau được gọi là phản ứng thuận nghịch.
- Trong phương trình hoá học của phản thuận nghịch người ta dùng kí hiệu hai nửa mũi tên ngược chiều ():
+ chiều từ trái sang phải là chiều thuận
+ chiều từ phải sang trái là chiều nghịch..
* Ví dụ: Cl2(g) + H2O(l) ⇌⇌HCl(aq) + HClO(aq)
1.3. Trạng thái cân bằng của phản ứng thuận nghịch
Cho phản ứng thuận nghịch:
N2(g) + 3H2(g) 2NH3(g)
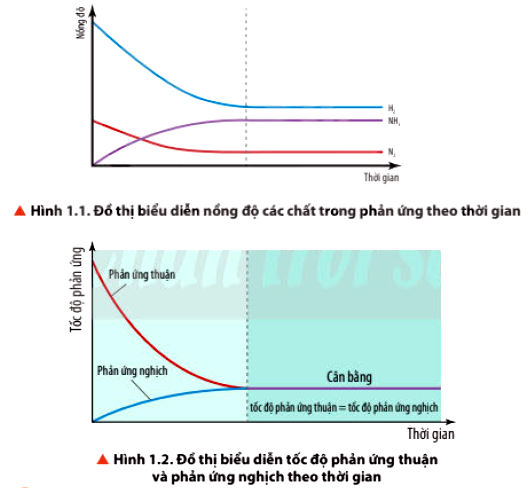
- Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
* Chú ý:
Cân bằng hoá học là một cân bằng động, vì tại trạng thái cân bằng, phản ứng thuận và phản ứng nghịch vẫn xảy ra, nhưng tốc độ bằng nhau nên không nhận thấy sự thay đổi thành phần của hệ.
2. Hằng số cân bằng của phản ứng thuận nghịch
Tổng quát, nếu có phản ứng thuận nghịch sau:
aA + bB cC + dD
Khi phản ứng ở trạng thái cân bằng, ta có:
Trong đó (A), (B), (C) và (D) là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
Trong phản ứng thuận nghịch, hằng số cân bằng KC của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
3. Sự chuyển dịch cân bằng hoá học
- Sự chuyển dịch cân bằng hoá học là sự dịch chuyển tử trạng thái cân bằng này sang trạng thái cân bằng khác.
4. Các yếu tố ảnh hưởng đến cân bằng hoá học
• Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
• Ảnh hưởng của nhiệt độ đến cân bằng hoá học:
Khi hệ đang ở trạng thái cân bằng, nếu tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt. Ngược lại, khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng toả nhiệt.
* Ví dụ: Xét phản ứng:
2NO2(g) N2O4(g) ∆H = –58kJ
(nâu đỏ) (không màu)
Khi phản ứng trên đang ở trạng thái cân bằng, nếu làm nóng hỗn hợp khí bằng cách ngâm bình vào nước nóng, màu nâu đỏ của hỗn hợp khí đậm lên. Nếu làm lạnh bằng cách ngâm bình đựng hỗn hợp khí vào nước đá, màu của hỗn hợp nhạt đi.
• Ảnh hưởng của áp suất đến cân bằng hoá học:
+ Khi hệ đang ở trạng thái cân bằng, nếu tăng hoặc giảm áp suất của hệ, cân bằng chuyển dịch theo chiều làm giảm hoặc tăng số mol khí.
+ Khi hệ cân bằng có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau hoặc trong hệ không có chất khí, việc tăng hoặc giảm áp suất không làm chuyển dịch cân bằng của hệ.
* Ví dụ: Xét phản ứng:
2NO2(g) N2O4(g)
(nâu đỏ) (không màu)
Khi hệ đạt trạng thái cân bằng, nếu tăng áp suất của hệ bằng cách đẩy pit – tông để thể tích của hệ giảm, lúc này màu nâu đỏ nhạt dần, cân bằng chuyển dịch theo chiều thuận. Ngược lại, nếu làm giảm áp suất của hệ cân bằng trên bằng cách kéo pit – tông ra để thể tích của hệ tăng lên, cân bằng sẽ chuyển dịch theo chiều nghịch, màu nâu đậm dần.
• Ảnh hưởng của nồng độ đến cân bằng hoá học:
Khi tăng hoặc giảm nồng độ một chất trong hệ cân bằng thì cân bằng sẽ chuyển dịch tương ứng theo chiều làm giảm hoặc tăng nồng độ của chất đó.
* Ví dụ: Xét hệ cân bằng sau trong bình kín ở nhiệt độ cao:
C(s) + CO2(g) 2CO(g)
Khi thổi thêm khí CO2 vào hệ cân bằng thì nồng đồ CO2 tăng lên, lượng CO phải tăng lên làm cân bằng chuyển dịch theo chiều thuận.
* Chú ý: Chất xúc tác không làm thay đổi nồng độ các chất trong hệ cân bằng và cũng không làm thay đổi hằng số cân bằng nên không làm chuyển dịch cân bằng. Chất xúc tác có tác dụng làm tăng tốc độ phản ứng thuận nghịch nên làm cho hệ nhanh chóng đạt trạng thái cân bằng.
Với nội dung bài viết về: Cân bằng hoá học là gì, hằng số cân bằng của phản ứng và sự dịch chuyển của cân bằng? Hoá 11 chân trời bài 1 chi tiết, dễ hiểu ở trên. Hay Học Hỏi hy vọng giúp các em nắm vững nội dung Lý thuyết Hoá 11 Chân trời sáng tạo. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để được ghi nhận và hỗ trợ, chúc các em học tốt.
> Xem thêm Lý thuyết Hóa 11 Chân trời sáng tạo
Lý thuyết Hóa 11 Bài 2: Cân bằng trong dung dịch nước
Lý thuyết Hóa 11 Bài 3: Đơn chất nitrogen
Lý thuyết Hóa 11 Bài 4: Ammonia và một số hợp chất ammonium
Lý thuyết Hóa 11 Bài 5: Một số hợp chất với oxygen của nitrogen
Lý thuyết Hóa 11 Bài 6: Sulfur và sulfur dioxide
Lý thuyết Hóa 11 Bài 7: Sulfuric acid và muối sulfate
Lý thuyết Hóa 11 Bài 8: Hợp chất hữu cơ và hóa học hữu cơ
Đánh giá & nhận xét
-
 Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
-
 Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
-
 Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
-
 Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
-
 Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
-
 Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
-
 Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
-
 Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
-
 Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
-
 Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
-
 Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
-
 Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
-
 Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7
Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7
-
 Tính chất vật lí, tính chất hoá học của Sulfur (S), Sulfur dioxide (SO2) và ứng dụng? Hoá 11 chân trời bài 6
Tính chất vật lí, tính chất hoá học của Sulfur (S), Sulfur dioxide (SO2) và ứng dụng? Hoá 11 chân trời bài 6
-
 Tính chất vật lí, tính chất hoá học của Nitric Acid HNO3, hợp chất Oxide của Nitrogen? Hoá 11 chân trời bài 5
Tính chất vật lí, tính chất hoá học của Nitric Acid HNO3, hợp chất Oxide của Nitrogen? Hoá 11 chân trời bài 5
-
 Tính chất vật lí, tính chất hoá học của Ammonia (NH3), Ammonium và ứng dụng? Hoá 11 chân trời bài 4
Tính chất vật lí, tính chất hoá học của Ammonia (NH3), Ammonium và ứng dụng? Hoá 11 chân trời bài 4
-
 Nitrogen tính chất vật lí, tính chất hoá học của Nitrogen và ứng dụng? Hoá 11 chân trời bài 3
Nitrogen tính chất vật lí, tính chất hoá học của Nitrogen và ứng dụng? Hoá 11 chân trời bài 3
-
 Cân bằng trong dung dịch nước, thuyết Bronsted Lowry về Acid, Base, Khái niệm pH? Hoá 11 chân trời bài 2
Cân bằng trong dung dịch nước, thuyết Bronsted Lowry về Acid, Base, Khái niệm pH? Hoá 11 chân trời bài 2
-
 Mục lục SGK Hóa 11 Chân trời sáng tạo - Lý thuyết và bài tập Hóa 11 SGK Chân trời sáng tạo
Mục lục SGK Hóa 11 Chân trời sáng tạo - Lý thuyết và bài tập Hóa 11 SGK Chân trời sáng tạo


















































