Tính chất vật lí, tính chất hoá học của Nitric Acid HNO3, hợp chất Oxide của Nitrogen? Hoá 11 chân trời bài 5
Lý thuyết Bài 5: Một số hợp chất với Oxygen của Nitrogen chương 2 Hoá 11 Chân trời sáng tạo.
Nội dung về các Oxide của Nitrogen - hiện tượng mưa acid; cấu tạo phân tử, tính chất vật lí, tính chất hoá học của Nitric Acid và ứng dụng; hiện tượng phú dưỡng.
1. Các oxide của nitrogen – Hiện tượng mưa acid
1.1. Nguồn gốc của các oxide của nitrogen trong không khí
• Nitrogen oxide được hình thành từ những hiện tượng trong tự nhiên hoặc các thiết bị hoạt động ở nhiệt độ cao.
Các khí này độc, có thể gây ảnh hưởng nghiêm trọng đến sức khoẻ con người. Chúng cũng là một trong những nguyên nhân chính gây nên hiệu ứng nhà kính và hiện tượng mưa acid.
2N2 + O2 2NO (ở 30000C)
2NO + O2 → 2NO2
1.2. Hiện tượng mưa acid
• Mưa acid tạo thành do lượng khí thải SO2 và NO2 từ các quá trình tiêu thụ than đá, dầu mỏ và các nhiên liệu tự nhiên khác trong sản xuất, sinh hoạt của con người.
2SO2 + O2 + 2H2O 2H2SO4
4NO2 + O2 + 2H2O → 4HNO3
2. Nitric acid (HNO3) công thức cấu tạo, tính chất vật lí, tính chất hoá học của Nitric acid và ứng dụng
2.1. Cấu tạo phân tử của nitric acid
Nitric acid tinh khiết kém bền, bị phân huỷ một phần giải phóng khí nitrogen dioxide (NO2) ngay ở điều kiện thường khi có ánh sáng.
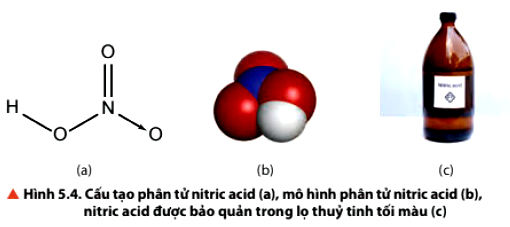
2.2. Tính chất vật lí của Nitric Acid (HNO3)
+ Nitric acid tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, có khối lượng riêng là 1,53 g/cm3, sôi ở 86C°.
+ Nitric acid tan trong nước theo bất kì tỉ lệ nào. Nitric acid thương mại thường có nồng độ 68%, khối lượng riêng là 1,40 g/cm3.
2.2. Tính chất hoá học của Nitric Acid (HNO3)
• Dung dịch HNO3 làm quỳ tím hoá đỏ; tác dụng với oxide base, base và muối của acid yếu hơn tạo thành muối nitrate.
HNO3 → H+ + NO3–
• Nitric acid HNO3 oxi hoá được hều hết các kim loại trừ vàng (Au), platinum (Pt),…
* Chú ý: Một số kim loại như Al, Fe và Cr bị thụ động hoá trong dung dịch HNO3 đặc, nguội, do tạo ra màng oxide bền, bảo vệ kim loại khỏi tác dụng của acid.
2.3. Ứng dụng của của Nitric Acid (HNO3)
• Trong hoá học hữu cơ, dung dịch HNO3 68% được sử dụng chế tạo thuốc nổ như TNT, sản xuất nitrobenzene.
• Hỗn hợp HNO3 đặc và HCl đặc (tỉ lệ thể tích/mol là 1 : 3) được gọi là nước cường toan. Dung dịch này có khả năng hoà tan platinum và vàng.
* Kết luận: Nitric acid là một acid mạnh và có tính oxi hoá mạnh. Dung dịch nitric acid có nhiều ứng dụng quan trọng trong đời sống và sản xuất.
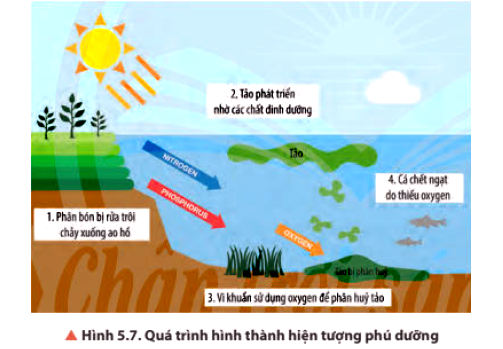
3. Hiện tượng phú dưỡng
Hiện tượng phú dưỡng xảy ra khi dư thừa chất dinh dưỡng trong môi trường nước như nitrate và phosphate, làm suy giảm chất lượng nước, gây ảnh hưởng tiêu cực đến đời sống con người cũng như các loài động vật sống dưới nước.
Với nội dung bài viết về: Tính chất vật lí, tính chất hoá học của Nitric Acid HNO3, hợp chất Oxide của Nitrogen? Hoá 11 chân trời bài 5 chi tiết, dễ hiểu ở trên. Hay Học Hỏi hy vọng giúp các em nắm vững nội dung Lý thuyết Hoá 11 Chân trời sáng tạo. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để được ghi nhận và hỗ trợ, chúc các em học tốt.
> Xem thêm Lý thuyết Hóa 11 Chân trời sáng tạo
Lý thuyết Hóa 11 Bài 2: Cân bằng trong dung dịch nước
Lý thuyết Hóa 11 Bài 3: Đơn chất nitrogen
Lý thuyết Hóa 11 Bài 4: Ammonia và một số hợp chất ammonium
Lý thuyết Hóa 11 Bài 6: Sulfur và sulfur dioxide
Lý thuyết Hóa 11 Bài 7: Sulfuric acid và muối sulfate
Lý thuyết Hóa 11 Bài 8: Hợp chất hữu cơ và hóa học hữu cơ
Lý thuyết Hóa 11 Bài 9: Phương pháp tách và tinh chế hợp chất hữu cơ
Đánh giá & nhận xét
-
 Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
-
 Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
-
 Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
-
 Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
-
 Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
-
 Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
-
 Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
-
 Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
-
 Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
-
 Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
-
 Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
-
 Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
-
 Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7
Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7
-
 Tính chất vật lí, tính chất hoá học của Sulfur (S), Sulfur dioxide (SO2) và ứng dụng? Hoá 11 chân trời bài 6
Tính chất vật lí, tính chất hoá học của Sulfur (S), Sulfur dioxide (SO2) và ứng dụng? Hoá 11 chân trời bài 6
-
 Tính chất vật lí, tính chất hoá học của Ammonia (NH3), Ammonium và ứng dụng? Hoá 11 chân trời bài 4
Tính chất vật lí, tính chất hoá học của Ammonia (NH3), Ammonium và ứng dụng? Hoá 11 chân trời bài 4
-
 Nitrogen tính chất vật lí, tính chất hoá học của Nitrogen và ứng dụng? Hoá 11 chân trời bài 3
Nitrogen tính chất vật lí, tính chất hoá học của Nitrogen và ứng dụng? Hoá 11 chân trời bài 3
-
 Cân bằng trong dung dịch nước, thuyết Bronsted Lowry về Acid, Base, Khái niệm pH? Hoá 11 chân trời bài 2
Cân bằng trong dung dịch nước, thuyết Bronsted Lowry về Acid, Base, Khái niệm pH? Hoá 11 chân trời bài 2
-
 Cân bằng hoá học là gì, hằng số cân bằng của phản ứng và sự dịch chuyển của cân bằng? Hoá 11 chân trời bài 1
Cân bằng hoá học là gì, hằng số cân bằng của phản ứng và sự dịch chuyển của cân bằng? Hoá 11 chân trời bài 1
-
 Mục lục SGK Hóa 11 Chân trời sáng tạo - Lý thuyết và bài tập Hóa 11 SGK Chân trời sáng tạo
Mục lục SGK Hóa 11 Chân trời sáng tạo - Lý thuyết và bài tập Hóa 11 SGK Chân trời sáng tạo


















































