Cân bằng trong dung dịch nước, thuyết Bronsted Lowry về Acid, Base, Khái niệm pH? Hoá 11 chân trời bài 2
Lý thuyết Bài 2: Cân bằng trong dung dịch nước chương 1 Hoá 11 Chân trời sáng tạo.
Nội dung về cân bằng hoá học trong dung dịch nước; sự điện li, chất điện li, chất không điện li; Bronsted – Lowry về acid - base; Khái niệm pH. Chất chỉ thị acid – base; Ý nghĩa thực tiễn cân bằng trong dung dịch nước.
1. Sự điện li, chất điện li, chất không điện li
1.1. Hiện tượng điện li
• Quá trình phân li các chất trong nước tạo thành các ion được gọi là sự điện li
* Ví dụ: NaCl → Na+ + Cl–
* Chú ý: Trong dung dịch, chất điện li phân li thành các ion. Phương trình ion cho biết bản chất của phản ứng xảy ra trong dung dịch điện li. Ví dụ một số phương trình ion:
H+ + OH– → H2O
H+ + HCO3– → CO2↑ + H2O
Ba2+ + SO42– → BaSO4↓
1.2. Sự phân loại các chất điện li
• Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li thành ion.
* Ví dụ: HCl → H+ + Cl–
Chất điện li mạnh bao gồm acid mạnh, base mạnh và hầu hết các muối. Trong phương trình điện li của chất điện li mạnh, người ta dùng một mũi tên chỉ chiều của quá trình điện li.
• Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hoà tan phân li thành ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
* Ví dụ: CH3COOH CH3COO– + H+
Chất điện li yếu bao gồm các acid yêu, base yếu,… Trong phương trình điện li của chất điện li yếu, người ta dùng hai nửa mũi tên ngược chiều nhau.
• Chất không điện li là chất khi hoà tan vào trong nước, các phân tử không phân li thành ion.
2. Thuyết Bronsted – Lowry về acid - base
• Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.
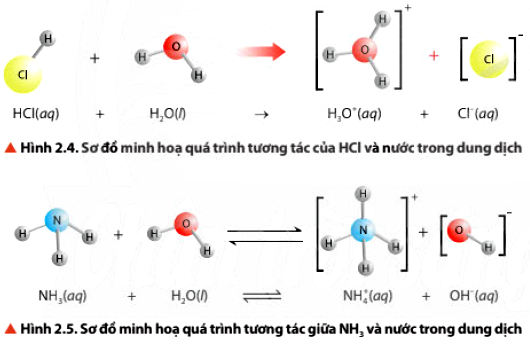
* Ví dụ:
HCO3– + H2O ⇌ H3O+ + CO32−
⇒ H3O+ cho H+ nên HCO3– có tính acid
HCO3– + H2O ⇌ H2CO3 + OH−
⇒ HCO3– nhận H+ nên HCO3– có tính base
Vậy ion HCO3– trong nước gọi là chất lưỡng tính (vừa có thể cho proton H+ , vừa có thể nhận proton).
3. Khái niệm pH. Chất chỉ thị acid – base
3.1. Khái niệm pH
- pH là chỉ số đánh gia độ acid hay độ base của một dung dịch
Độ acid và độ kiềm của dung dịch với quy ước như sau: pH = -lg[H+]
Nếu [H+] = 10−aM thì pH = a
Trong đó, [H+] là nồng độ mol của ion H+ trong dung dịch.
- Thang pH thường dùng có giá trị tử 1 đến 14.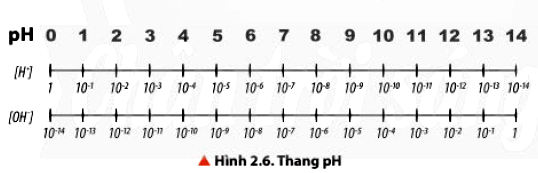
3.2. Ý nghĩa của pH trong thực tiễn
- Giá trị pH là một trong những yếu tố rất quan trọng phản ánh sức khoẻ của con người. Mỗi người cần duy trì được chế độ ăn phù hợp, duy trì được sức khoẻ tốt.
- Độ pH trong đất được dùng làm cơ sở cho việc sử dụng đất, sử dụng phân bón một cách hợp lí và hiệu quả nhằm bảo vệ chất lượng môi trường đất và phòng tránh ô nhiễm nguồn nước.
* Ví dụ: Bộ Y tế quy định ngưỡng giới hạn cho phép đối với độ pH trong nước là trong khoảng 6,0 – 8,5.
3.3. Chất chỉ thị acid – base
• Chất chỉ thị acid– base là chất có màu sắc biến đổi theo giá trị pH của dung dịch, như dung dịch phenolphtalein, quỳ tím,… Người ta có thể dùng máy đo pH để xác định giá trị pH của một dung dịch..
4. Chuẩn độ acid – base
• Trong phương pháp chuẩn độ acid – base, người ta thường dùng dung dịch acid hoặc dung dịch base (kiềm) để biết chính xác nồng độ làm dung dịch chuẩn để xác định nồng độ dung dịch base hoặc dung dịch acid chưa biết nồng độ.
5. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+, CO32–
• Ion Al3+, Fe3+, dễ bị phân huỷ trong nước tạo thành hydroxide không tan và cho môi trường acid.
Phèn chua hay phèn nhôm – kali (K2SO4.Al2(SO4)3.24H2O), phèn sắt ((NH4)2SO4.Fe2(SO4)3.24H2O)) được sử dụng như là chất keo tụ trong quá trình xử lí nước (nước thải, nước giếng khoan,…).
• Ion CO32– bị thuỷ phân cho môi trường base.
* Ví dụ: Soda (Na2CO3) được xem làm hoá chất hiệu quả được sử dụng để làm tăng pH của nước hồ bơi:
CO32− + H2O HCO3– + OH–
Với nội dung bài viết về: Cân bằng trong dung dịch nước, thuyết Bronsted Lowry về Acid, Base, Khái niệm pH? Hoá 11 chân trời bài 2 chi tiết, dễ hiểu ở trên. Hay Học Hỏi hy vọng giúp các em nắm vững nội dung Lý thuyết Hoá 11 Chân trời sáng tạo. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để được ghi nhận và hỗ trợ, chúc các em học tốt.
> Xem thêm Lý thuyết Hóa 11 Chân trời sáng tạo
Lý thuyết Hóa 11 Bài 1: Khái niệm về cân bằng hóa học
Lý thuyết Hóa 11 Bài 3: Đơn chất nitrogen
Lý thuyết Hóa 11 Bài 4: Ammonia và một số hợp chất ammonium
Lý thuyết Hóa 11 Bài 5: Một số hợp chất với oxygen của nitrogen
Lý thuyết Hóa 11 Bài 6: Sulfur và sulfur dioxide
Đánh giá & nhận xét
-
 Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
Carboxylic Acid cấu tạo, tính chất hoá học, tính chất vật lí của Carboxylic, điều chế và ứng dụng? Hoá 11 chân trời bài 19
-
 Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
Hợp chất Carbonyl là gì, tính chất hoá học, tính chất vật lí của hợp chất Carbonyl, điều chế và ứng dụng? Hoá 11 chân trời bài 18
-
 Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
Phenol là gì, tính chất hoá học, tính chất vật lí của Phenol, điều chế và ứng dụng? Hoá 11 chân trời bài 17
-
 Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
Alcohol là gì, tính chất hoá học, tính chất vật lí của Alcohol, điều chế và ứng dụng? Hoá 11 chân trời bài 16
-
 Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
Dẫn xuất Halogen là gì, Tính chất hoá học, tính chất vật lí của dẫn xuất Halogen và ứng dụng? Hoá 11 chân trời bài 15
-
 Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
Arene là gì, tính chất vật lí, tính chất hoá học của Arene (benzene và toluene), điều chế và ứng dụng arene? Hoá 11 chân trời bài 14
-
 Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
Alkene, alkyne là gì, tính chất vật lí, tính chất hoá học của alkene, alkyne, điều chế và ứng dụng? Hóa 11 chân trời bài 13
-
 Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
Alkane cấu tạo, danh pháp, tính chất hóa học, tính chất vật lí, điều chế và ứng dụng alkane? Hóa 11 chân trời bài 12
-
 Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
Công thức cấu tạo của hợp chất hữu cơ, thuyết cấu tạo hóa học? Hoá 11 chân trời bài 11
-
 Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
Cách lập Công thức phân tử của hợp chất hữu cơ, Xác định phân tử khối? Hoá 11 chân trời bài 10
-
 Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
Phương pháp tách và tinh chế hợp chất hữu cơ? Hoá 11 chân trời bài 9
-
 Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
Đặc điểm chung, phân loại hợp chất hữu cơ, nhóm chức và phổ hồng ngoại IR? Hoá 11 chân trời bài 8
-
 Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7
Tính chất vật lí, tính chất hoá học của Sulfuric acid H2SO4, ứng dụng của muối Sulfate? Hoá 11 chân trời bài 7
-
 Tính chất vật lí, tính chất hoá học của Sulfur (S), Sulfur dioxide (SO2) và ứng dụng? Hoá 11 chân trời bài 6
Tính chất vật lí, tính chất hoá học của Sulfur (S), Sulfur dioxide (SO2) và ứng dụng? Hoá 11 chân trời bài 6
-
 Tính chất vật lí, tính chất hoá học của Nitric Acid HNO3, hợp chất Oxide của Nitrogen? Hoá 11 chân trời bài 5
Tính chất vật lí, tính chất hoá học của Nitric Acid HNO3, hợp chất Oxide của Nitrogen? Hoá 11 chân trời bài 5
-
 Tính chất vật lí, tính chất hoá học của Ammonia (NH3), Ammonium và ứng dụng? Hoá 11 chân trời bài 4
Tính chất vật lí, tính chất hoá học của Ammonia (NH3), Ammonium và ứng dụng? Hoá 11 chân trời bài 4
-
 Nitrogen tính chất vật lí, tính chất hoá học của Nitrogen và ứng dụng? Hoá 11 chân trời bài 3
Nitrogen tính chất vật lí, tính chất hoá học của Nitrogen và ứng dụng? Hoá 11 chân trời bài 3
-
 Cân bằng hoá học là gì, hằng số cân bằng của phản ứng và sự dịch chuyển của cân bằng? Hoá 11 chân trời bài 1
Cân bằng hoá học là gì, hằng số cân bằng của phản ứng và sự dịch chuyển của cân bằng? Hoá 11 chân trời bài 1
-
 Mục lục SGK Hóa 11 Chân trời sáng tạo - Lý thuyết và bài tập Hóa 11 SGK Chân trời sáng tạo
Mục lục SGK Hóa 11 Chân trời sáng tạo - Lý thuyết và bài tập Hóa 11 SGK Chân trời sáng tạo


















































