Tính chất hóa học, tính chất vật lí Carbonyl? Khái niệm, cấu tạo, điều chế và ứng dụng Carbonyl? Hóa 11 bài 23 KNTT
Lý thuyết Hóa 11 Kết nối tri thức bài 23: Hợp chất Carbonyl, giúp các em biết Tính chất hóa học tính chất vật lí của Carbonyl, khái niệm, công thức cấu tạo, ứng dụng và điều chế Carbonyl?
Vậy Tính chất hóa học của hợp chất Carbonyl và tính chất vật lí Carbonyl như nào? khái niệm, danh pháp Carbonyl là gì? Đặc điểm công thức cấu tạo, ứng dụng và điều chế Carbonyl ra sao? được hayhochoi trình bày ngắn gọn, dễ hiểu trong bài viết này.
I. Khái niệm, danh pháp hợp chất carbonyl
1. Khái niệm hợp chất carbonyl
- Hợp chất carbonyl là các hợp chất hữu cơ trong phân tử có chứa nhóm chức carbonyl (>C=O ). Nhóm chức carbonyl có trong aldehyde, ketone...
+ Aldehyde là hợp chất hữu cơ có nhóm –CHO liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc –CHO) hoặc nguyên tử hydrogen.
+ Ketone là hợp chất hữu cơ có nhóm >C=O liên kết với hai gốc hydrocarbon.
Ví dụ:

2. Danh pháp hợp chất carbonyl
a) Danh pháp thay thế
Tên gọi theo danh pháp thay thế của aldehyde đơn chức và ketone đơn chức:
Tên aldehyde:
Tên hydrocarbon (bỏ e ở cuối) – al
Ví dụ: propanal

Tên ketone:
Tên hydrocarbon (bỏ e ở cuối) – vị trí nhóm C = O – one
Ví dụ: pentan-2-one

Chú ý:
- Mạch carbon là mạch dài nhất chứa nhóm >C=O.
- Mạch carbon được đánh số từ nhóm –CHO (đối với aldehyde) hoặc từ phía gần nhóm >C=O hơn (đối với ketone).
- Đối với ketone, nếu nhóm >C=O chỉ có một vị trí duy nhất thì không cần số chỉ vị trí nhóm >C=O.
- Nếu mạch carbon có nhánh thì cần thêm vị trí và tên nhánh ở phía trước.
b) Tên thông thường
Một số aldehyde, ketone đơn giản được gọi theo tên thông thường có nguồn gốc lịch sử. Tên thông thường của các aldehyde có nguồn gốc từ tên của acid tương ứng.
Ví dụ:
HCHO: aldehyde formic (formaldehyde)
CH3CHO: aldehyde acetic (acetaldehyde)
C6H5CHO: aldehyde benzoic (benzaldehyde)
CH3COCH3: acetone
II. Đặc điểm cấu tạo hợp chất carbonyl
Liên kết đôi C = O phân cực về phía nguyên tử oxygen:

III. Tính chất vật lí carbonyl
Các aldehyde, ketone có nhiệt độ sôi cao hơn các hydrocarbon có khối lượng phân tử tương đương do trong phân tử chứa nhóm carbonyl phân cực làm cho phân tử aldehyde, ketone phân cực nên có nhiệt độ sôi cao hơn.
Ở nhiệt độ thường, các aldehyde có phân tử khối nhỏ (methanal, ethanal) ở trạng thái khí, các hợp chất carbonyl thông dụng khác ở trạng thái lỏng.
Các aldehyde, ketone có mạch carbon ngắn tan tốt trong nước. Khi số nguyên tử carbon tăng thì độ tan của hợp chất carbonyl giảm dần.

IV. Tính chất hoá học carbonyl
1. Phản ứng khử
Các hợp chất carbonyl bị khử bởi các tác nhân khử như NaBH4, LiAlH4, … (kí hiệu: [H]) tạo thành các alcohol tương ứng: aldehyde bị khử thành alcohol bậc I, ketone bị khử thành alcohol bậc II.
Ví dụ:
2. Phản ứng oxi hoá aldehyde
Aldehyde dễ bị oxi hoá bởi các tác nhân oxi hoá thông thường như: Br2/H2O, [Ag(NH3)2]OH, Cu(OH)2/OH- ….
a) Oxi hoá aldehyde bởi nước bromine
Aldehyde bị oxi hoá bởi nước bromine tạo thành carboxylic acid.
Ví dụ: CH3CHO + Br2 + H2O → CH3COOH + 2HBr
b) Oxi hoá aldehyde bởi thuốc thử Tollens
Thuốc thử Tollens là phức chất của ion Ag+ với ammonia, có công thức [Ag(NH3)2]OH. Ion Ag+ trong thuốc thử Tollens đóng vai trò là chất oxi hoá:
RCHO + 2[Ag(NH3)2]OH RCOONH4 + 2Ag + 3NH3 + H2O
Ví dụ: CH3CHO + 2[Ag(NH3)2]OH CH3COONH4 + 2Ag + 3NH3 + H2O
Phản ứng tạo thành lớp bạc sáng bóng bám vào bình phản ứng, vì vậy phản ứng này còn được gọi là phản ứng tráng bạc.
Ketone không bị oxi hoá bởi thuốc thử Tollens, vì vậy có thể dùng thuốc thử Tollens để phân biệt aldehyde với ketone và các hợp chất khác.
c) Oxi hoá aldehyde bằng copper(II) hydroxide
Aldehyde có thể bị oxi hoá bởi copper(II) hidroxide Cu(OH)2 trong môi trường kiềm khi đun nóng tạo thành kết tủa copper(I) oxide (Cu2O) màu đỏ gạch:
RCHO + 2Cu(OH)2 + NaOH RCOONa + Cu2O + 3H2O
3. Phản ứng cộng
Hợp chất carbonyl có thể tham gia phản ứng cộng với HCN vào liên kết đôi C = O.
 Ví dụ:
Ví dụ:

4. Phản ứng tạo iodoform
Các hợp chất aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl có thể phản ứng với I2 trong môi trường kiềm.
Ví dụ:

Phản ứng tạo sản phẩm kết tủa iodoform nên phản ứng này được gọi là phản ứng iodoform và được dùng để nhận biết các aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl.
V. Ứng dụng của carbonyl: aldehyde và ketone
Một số ứng dụng của aldehyde và ketone được thể hiện trong sơ đồ sau:
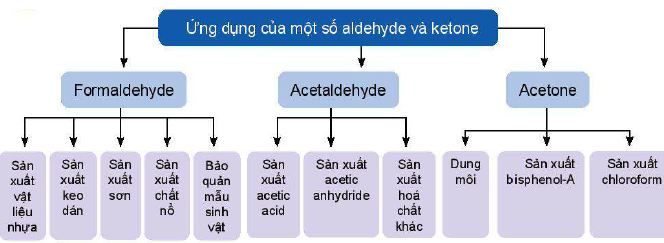
VI. Điều chế carbonyl
Một số hợp chất carbonyl được tổng hợp trong công nghiệp bằng phương pháp oxi hoá các hydrocarbon, oxi hoá ethylene thành acetaldehyde, oxi hoá cumene thành acetone.
Với nội dung bài viết về: Tính chất hóa học, tính chất vật lí Carbonyl? Khái niệm, cấu tạo, điều chế và ứng dụng Carbonyl? Hóa 11 bài 23 KNTT chi tiết, dễ hiểu ở trên. Hay Học Hỏi hy vọng giúp các em nắm vững nội dung Lý thuyết Hoá 11 Kết nối tri thức. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để được ghi nhận và hỗ trợ, chúc các em học tốt.
> Xem Lý thuyết Hóa 11 Kết nối tri thức
Lý thuyết Hóa 11 Bài 20: Alcohol
Lý thuyết Hóa 11 Bài 21: Phenol
Lý thuyết Hóa 11 Bài 22: Ôn tập chương 5
Đánh giá & nhận xét
-
 Ôn tập chương 6: Hợp chất Carbonyl, Carboxylic acid? Hóa 11 bài 25 KNTT (Kết nối tri thức)
Ôn tập chương 6: Hợp chất Carbonyl, Carboxylic acid? Hóa 11 bài 25 KNTT (Kết nối tri thức)
-
 Tính chất hóa học, tính chất vật lí Carboxylic Acid? Cấu tạo, điều chế và ứng dụng Carboxylic Acid? Hóa 11 bài 24 KNTT
Tính chất hóa học, tính chất vật lí Carboxylic Acid? Cấu tạo, điều chế và ứng dụng Carboxylic Acid? Hóa 11 bài 24 KNTT
-
 Ôn tập chương 5: Dẫn xuất halogen, Alcohol, Phenol? Hóa 11 bài 22 KNTT (Kết nối tri thức)
Ôn tập chương 5: Dẫn xuất halogen, Alcohol, Phenol? Hóa 11 bài 22 KNTT (Kết nối tri thức)
-
 Tính chất hóa học Phenol, tính chất vật lí Phenol? Khái niệm, cấu tạo, điều chế và ứng dụng Phenol? Hóa 11 bài 21 KNTT
Tính chất hóa học Phenol, tính chất vật lí Phenol? Khái niệm, cấu tạo, điều chế và ứng dụng Phenol? Hóa 11 bài 21 KNTT
-
 Tính chất hóa học Alcohol, tính chất vật lí Alcohol? Khái niệm, cấu tạo, điều chế và ứng dụng Alcohol? Hóa 11 bài 20 KNTT
Tính chất hóa học Alcohol, tính chất vật lí Alcohol? Khái niệm, cấu tạo, điều chế và ứng dụng Alcohol? Hóa 11 bài 20 KNTT
-
 Tính chất hóa học tính chất vật lí Halogen? Khái niệm, đặc điểm cấu tạo và ứng dụng Halogen? Hóa 11 bài 19 KNTT
Tính chất hóa học tính chất vật lí Halogen? Khái niệm, đặc điểm cấu tạo và ứng dụng Halogen? Hóa 11 bài 19 KNTT
-
 Ôn tập chương 4: Hydrocarbon? Hóa 11 bài 18 KNTT (Kết nối tri thức)
Ôn tập chương 4: Hydrocarbon? Hóa 11 bài 18 KNTT (Kết nối tri thức)
-
 Tính chất hóa học Arene, tính chất vật lí Arene? Công thức cấu tạo, điều chế và ứng dụng Arene? Hóa 11 bài 17 KNTT
Tính chất hóa học Arene, tính chất vật lí Arene? Công thức cấu tạo, điều chế và ứng dụng Arene? Hóa 11 bài 17 KNTT
-
 Tính chất hóa học tính chất vật lí Alkene, Alkyne? Cấu tạo, điều chế và ứng dụng Alkene Alkyne? Hóa 11 bài 16 KNTT
Tính chất hóa học tính chất vật lí Alkene, Alkyne? Cấu tạo, điều chế và ứng dụng Alkene Alkyne? Hóa 11 bài 16 KNTT
-
 Tính chất hóa học Alkane, tính chất vật lí Alkane, khái niệm, cấu tạo, ứng dụng và điều chế Alkane? Hóa 11 bài 15 KNTT
Tính chất hóa học Alkane, tính chất vật lí Alkane, khái niệm, cấu tạo, ứng dụng và điều chế Alkane? Hóa 11 bài 15 KNTT
-
 Khái niệm Công thức cấu tạo, đồng đẳng đồng phân hợp chất hữu cơ? thuyết cấu tạo hóa học? Hóa 11 bài 14 KNTT
Khái niệm Công thức cấu tạo, đồng đẳng đồng phân hợp chất hữu cơ? thuyết cấu tạo hóa học? Hóa 11 bài 14 KNTT
-
 Khái niệm Công thức cấu tạo, đồng đẳng đồng phân hợp chất hữu cơ? thuyết cấu tạo hóa học? Hóa 11 bài 13 KNTT
Khái niệm Công thức cấu tạo, đồng đẳng đồng phân hợp chất hữu cơ? thuyết cấu tạo hóa học? Hóa 11 bài 13 KNTT
-
 Lập Công thức phân tử hợp chất hữu cơ? Khái niệm, cách biểu diễn CTPT hợp chất hữu cơ? Hóa 11 bài 12 KNTT
Lập Công thức phân tử hợp chất hữu cơ? Khái niệm, cách biểu diễn CTPT hợp chất hữu cơ? Hóa 11 bài 12 KNTT
-
 Các phương pháp tách và tinh chế hợp chất hữu cơ: Chưng cất, chiết, kết tinh, sắc kí cột? Hóa 11 bài 11 KNTT
Các phương pháp tách và tinh chế hợp chất hữu cơ: Chưng cất, chiết, kết tinh, sắc kí cột? Hóa 11 bài 11 KNTT
-
 Hợp chất hữu cơ là gì? đặc điểm, cách phân loại hợp chất hữu cơ? Khái niệm nhóm chức là gì? Hóa 11 bài 10 KNTT
Hợp chất hữu cơ là gì? đặc điểm, cách phân loại hợp chất hữu cơ? Khái niệm nhóm chức là gì? Hóa 11 bài 10 KNTT
-
 Ôn tập chương 2: Nitrogen-Sulfur? Hóa 11 bài 9 KNTT (Kết nối tri thức)
Ôn tập chương 2: Nitrogen-Sulfur? Hóa 11 bài 9 KNTT (Kết nối tri thức)
-
 Tính chất hóa học, vật lí của Sulfuric Acid H2SO4, cấu tạo phân tử và ứng dụng của muối Sulfate? Hóa 11 bài 8 KNTT
Tính chất hóa học, vật lí của Sulfuric Acid H2SO4, cấu tạo phân tử và ứng dụng của muối Sulfate? Hóa 11 bài 8 KNTT
-
 Tính chất hóa học, vật lí của Sulfur (S), Sulfur dioxide (SO2)? Cấu tạo sulfur, ứng dụng sulfur dioxide? Hóa 11 bài 7 KNTT
Tính chất hóa học, vật lí của Sulfur (S), Sulfur dioxide (SO2)? Cấu tạo sulfur, ứng dụng sulfur dioxide? Hóa 11 bài 7 KNTT
-
 Tính chất hóa học, vật lí của Acid Nitric? Các oxide của nitrogen, công thức, tên gọi, mưa acid? Hóa 11 bài 6 KNTT
Tính chất hóa học, vật lí của Acid Nitric? Các oxide của nitrogen, công thức, tên gọi, mưa acid? Hóa 11 bài 6 KNTT
-
 Tính chất hóa học của Ammonia NH3, muối Ammonium? Cấu tạo phân tử, tính chất vật lí Ammonia và ứng dụng? Hóa 11 bài 5 KNTT
Tính chất hóa học của Ammonia NH3, muối Ammonium? Cấu tạo phân tử, tính chất vật lí Ammonia và ứng dụng? Hóa 11 bài 5 KNTT
-
 Tính chất hóa học của Nitrogen (N2)? Tính chất vật lí, cấu tạo phân tử và ứng dụng Nitrogen? Hóa 11 bài 4 KNTT
Tính chất hóa học của Nitrogen (N2)? Tính chất vật lí, cấu tạo phân tử và ứng dụng Nitrogen? Hóa 11 bài 4 KNTT
-
 Ôn tập chương 1: Cân bằng hóa học? Hóa 11 bài 3 KNTT (Kết nối tri thức)
Ôn tập chương 1: Cân bằng hóa học? Hóa 11 bài 3 KNTT (Kết nối tri thức)
-
 Thuyết Acid Base của Bronsted Lowry, khái niệm Acid-Base, pH và ý nghĩa của pH trong thực tiễn? Hóa 11 bài 2 KNTT
Thuyết Acid Base của Bronsted Lowry, khái niệm Acid-Base, pH và ý nghĩa của pH trong thực tiễn? Hóa 11 bài 2 KNTT
-
 Phản ứng một chiều, phản ứng thuận nghịch là gì? hằng số cân bằng hóa học, các yếu tố ảnh hưởng? Hóa 11 bài 1 KNTT
Phản ứng một chiều, phản ứng thuận nghịch là gì? hằng số cân bằng hóa học, các yếu tố ảnh hưởng? Hóa 11 bài 1 KNTT
-
 Mục lục SGK Hóa 11 Kết nối tri thức - Lý thuyết và bài tập Hóa 11 SGK Kết nối tri thức
Mục lục SGK Hóa 11 Kết nối tri thức - Lý thuyết và bài tập Hóa 11 SGK Kết nối tri thức


















































