Giải bài 4 trang 29 Hoá 11 SGK Chân trời sáng tạo
Chào các em! Hôm nay, chúng ta sẽ cùng nhau giải chi tiết Bài 4 trang 29 SGK Hóa 11 thuộc bộ sách Chân trời sáng tạo. Bài toán này giúp chúng ta ôn tập và vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier để dự đoán chiều dịch chuyển của một phản ứng thuận nghịch.
Đề bài:
Cho cân bằng hoá học:
N2(g) + 3H2(g) 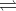 2NH3(g) ΔrHo298 = - 92kJ
2NH3(g) ΔrHo298 = - 92kJ
Cân bằng chuyển dịch theo chiều nào (có giải thích) khi:
a) tăng nhiệt độ.
b) tách ammonia ra khỏi hỗn hợp phản ứng.
c) giảm thể tích của hệ phản ứng.
Phân tích và Hướng dẫn giải:
Để dự đoán chiều chuyển dịch của cân bằng, chúng ta sẽ sử dụng nguyên lí Le Chatelier, phát biểu rằng:
"Một cân bằng đang ở trạng thái ổn định, khi chịu một tác động từ bên ngoài (thay đổi nồng độ, nhiệt độ, hoặc áp suất), cân bằng sẽ tự động chuyển dịch theo chiều chống lại sự thay đổi đó."
Chúng ta sẽ phân tích từng tác động cụ thể mà đề bài đưa ra.
Lời giải chi tiết:
a) Phản ứng có ΔrHo298 < 0
→ phản ứng tỏa nhiệt
khi tăng nhiệt độ thì phản ứng xảy ra theo phản ứng thu nhiệt (chiều nghịch)
b) Khi tách Ammonia ra khỏi hỗn hợp phản ứng thì cân bằng xảy ra theo chiều làm tăng chất sản phẩm
→ cân bằng xảy ra theo chiều thuận
c) Giảm thể tích của hệ phản ứng
→ giảm số phân tử khí
→ cân bằng chuyển dịch theo tăng số phân tử khí (chiều nghịch)
Qua bài tập này, các em đã rèn luyện kỹ năng vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier. Nguyên lí này là công cụ hữu ích để dự đoán sự thay đổi của một hệ cân bằng khi chịu tác động từ môi trường bên ngoài. Việc nắm vững cách phân tích từng yếu tố (nhiệt độ, nồng độ, áp suất) sẽ giúp các em giải quyết các bài toán về cân bằng hóa học một cách chính xác.
• Xem thêm:
Bài 1 trang 29 Hoá 11 SGK Chân trời sáng tạo: Liên kết hóa học trong phân tử NH3 là liên kết...
Đánh giá & nhận xét
-
 Giải bài 3 trang 107 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 107 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 107 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 107 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 107 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 107 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 98 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 98 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 98 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 98 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 98 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 98 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 51 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 51 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 51 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 51 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 51 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 51 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 5 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 5 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 23 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 23 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 23 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 23 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 23 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 23 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 5 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 5 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 23 SGK Chân trời sáng tạo
Giải Hóa 11 trang 23 SGK Chân trời sáng tạo
-
 Giải bài 5 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 5 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 11 Hoá 11 SGK Chân trời sáng tạo


















































