Giải bài 2 trang 29 Hoá 11 SGK Chân trời sáng tạo
Chào các em! Hôm nay, chúng ta sẽ cùng nhau giải chi tiết Bài 2 trang 29 SGK Hóa 11 thuộc bộ sách Chân trời sáng tạo. Bài toán này giúp chúng ta ôn tập một phản ứng nhận biết quan trọng trong hóa học: nhận biết ion ammonium (NH4+) bằng dung dịch kiềm.
Đề bài:
Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một khí, khí đó là
A. NH3. B. H2.
C. NO2. D. NO.
Phân tích và Hướng dẫn giải:
Để xác định loại khí thoát ra, chúng ta cần dựa vào tính chất hóa học đặc trưng của ion ammonium (NH4+). Ion này có thể dễ dàng phản ứng với các dung dịch kiềm (chứa ion hydroxide, OH−) để tạo ra một chất khí.
Phản ứng này là một phản ứng trao đổi ion. Khi ion NH4+ gặp ion OH−, chúng sẽ kết hợp với nhau để tạo ra một phân tử bền hơn là amoniac (NH3) và nước (H2O).
Phản ứng ion thu gọn có thể được viết như sau:NH4+(aq)+OH−(aq)→NH3(g)+H2O(l)
Khí sinh ra, amoniac (NH3), có mùi khai đặc trưng và làm xanh giấy quỳ tím ẩm. Đây là một phản ứng nhận biết điển hình trong phòng thí nghiệm.
Lời giải chi tiết:
Đáp án: A. NH3.
Muối ammonium tác dụng với dung dịch kiềm thoát ra khí NH3
Qua bài tập này, các em đã củng cố kiến thức về phản ứng nhận biết ion ammonium. Hãy luôn ghi nhớ phản ứng đặc trưng này: muối ammonium + dung dịch kiềm → khí amoniac + muối mới + nước. Phản ứng này là cơ sở cho phương pháp nhận biết các hợp chất chứa ion NH4+ trong hóa học phân tích.
• Xem thêm:
Bài 1 trang 29 Hoá 11 SGK Chân trời sáng tạo: Liên kết hóa học trong phân tử NH3 là liên kết...
Đánh giá & nhận xét
-
 Giải bài 4 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 5 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 5 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 23 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 23 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 23 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 23 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 23 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 23 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 5 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 5 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 23 SGK Chân trời sáng tạo
Giải Hóa 11 trang 23 SGK Chân trời sáng tạo
-
 Giải bài 5 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 5 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 90 Chân trời sáng tạo SGK
Giải Hóa 11 trang 90 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 88 Chân trời sáng tạo SGK
Giải Hóa 11 trang 88 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 73 SGK Chân trời sáng tạo
Giải Hóa 11 trang 73 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 66 Chân trời sáng tạo SGK
Giải Hóa 11 trang 66 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 67 Chân trời sáng tạo SGK
Giải Hóa 11 trang 67 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 41 Chân trời sáng tạo SGK
Giải Hóa 11 trang 41 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 91 SGK Chân trời sáng tạo
Giải Hóa 11 trang 91 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 89 Chân trời sáng tạo SGK
Giải Hóa 11 trang 89 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 87 Chân trời sáng tạo SGK
Giải Hóa 11 trang 87 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 86 Chân trời sáng tạo SGK
Giải Hóa 11 trang 86 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 85 Chân trời sáng tạo SGK
Giải Hóa 11 trang 85 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 84 SGK Chân trời sáng tạo
Giải Hóa 11 trang 84 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 83 Chân trời sáng tạo SGK
Giải Hóa 11 trang 83 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 82 Chân trời sáng tạo SGK
Giải Hóa 11 trang 82 Chân trời sáng tạo SGK






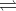 2NH3(g)
2NH3(g) 











































