Giải bài 3 trang 29 Hoá 11 SGK Chân trời sáng tạo
Chào các em! Hôm nay, chúng ta sẽ cùng nhau giải chi tiết Bài 3 trang 29 SGK Hóa 11 thuộc bộ sách Chân trời sáng tạo. Đây là một bài toán thực tế rất thú vị, liên quan đến vấn đề ô nhiễm môi trường và ứng dụng hóa học để xử lý. Bài toán yêu cầu đề xuất các hóa chất để chuyển ion ammonium (NH4+) thành khí nitrogen (N2) không độc
Đề bài:
Khi thải rác thải sinh hoạt chứa một lượng lớn ion ammonium vào ao, hồ sẽ sinh ra quá trình oxi hóa ammonium thành ion nitrate dưới tác dụng của vi khuẩn. Quá trình này làm giảm oxygen hòa tan trong nước, gây ngạt cho sinh vật sống dưới nước.
Người ta phải xử lý nguồn nước gây ô nhiễm đó bằng cách chuyển ion ammonium thành ammonia, rồi chuyển tiếp thành nitrogen không độc. Hãy đề xuất một số hóa chất thực hiện quá trình trên. Viết phương trình hóa học của phản ứng xảy ra.
Phân tích và Hướng dẫn giải:
Đề bài đưa ra một vấn đề ô nhiễm nước do ion ammonium (NH4+) và đề xuất một phương pháp xử lý gồm hai giai đoạn:
-
Chuyển ion ammonium thành amoniac (NH3).
-
Chuyển amoniac thành khí nitrogen (N2) không độc.
Để thực hiện các quá trình này, chúng ta cần tìm các hóa chất có khả năng:
-
Giai đoạn 1: Phản ứng với ion NH4+ để tạo ra NH3. Đây là một phản ứng nhận biết điển hình của ion ammonium, xảy ra khi có sự tham gia của ion OH−.
-
Giai đoạn 2: Oxi hóa NH3 thành N2. Để thực hiện phản ứng này, chúng ta cần một chất oxi hóa. Trong thực tế, các hợp chất chứa NO2− có thể đóng vai trò này.
Lời giải chi tiết:
Để xử lý nguồn nước bị ô nhiễm do ion ammonium, chúng ta có thể thực hiện theo quy trình sau:
Giai đoạn 1: Chuyển ion ammonium thành ammonia
Để chuyển ion NH4+ thành amoniac (NH3), ta cần thêm vào dung dịch một chất kiềm. Các hóa chất kiềm phổ biến có thể sử dụng là:
-
Dung dịch natri hiđroxit (NaOH).
-
Dung dịch kali hiđroxit (KOH).
-
Dung dịch canxi hiđroxit (Ca(OH)2).
Phản ứng này là một phản ứng trao đổi ion. Ví dụ, khi cho dung dịch NaOH vào dung dịch chứa ion NH4+:
NH4+(aq)+OH−(aq) → NH3(g)↑+H2O(l)
Hoặc với muối ammonium cụ thể:
NH4Cl(aq)+NaOH(aq) → NH3(g)↑+NaCl(aq)+H2O(l)
Khí NH3 tạo ra có thể thu được và chuyển sang giai đoạn tiếp theo.
Giai đoạn 2: Chuyển amoniac thành nitrogen không độc
Amoniac (NH3) có thể bị oxi hóa để tạo thành khí nitrogen (N2). Trong thực tế, quá trình này thường được thực hiện bởi vi khuẩn trong một quá trình gọi là anammox. Chúng ta có thể sử dụng các hóa chất chứa ion nitrit (NO2−) để oxi hóa amoniac.
Phản ứng hóa học tổng quát diễn ra trong môi trường nước có thể được biểu diễn như sau:
NH3+HNO2 → N2↑+2H2O
(Lưu ý: HNO2 là axit nitrơ, có thể được tạo ra từ ion nitrit NO2− trong môi trường axit.)
Tuy nhiên, trong các nhà máy xử lý nước thải, quá trình này phức tạp hơn và có sự tham gia của vi khuẩn. Ion nitrit được tạo ra từ quá trình oxi hóa một phần amoniac. Sau đó, nitrit sẽ phản ứng với phần amoniac còn lại để tạo ra khí nitrogen.
NH4++NO2− → N2↑+2H2O
Vì vậy, các hóa chất cần thiết là dung dịch kiềm (như NaOH) và một chất oxi hóa có khả năng chuyển amoniac thành khí nitrogen.
Để xử lý nguồn nước ô nhiễm chứa ion ammonium, chúng ta cần một quy trình hai bước. Đầu tiên, sử dụng một dung dịch kiềm để chuyển NH4+ thành khí amoniac (NH3). Sau đó, sử dụng một chất oxi hóa (như ion nitrit NO2−) để chuyển amoniac thành khí nitrogen (N2) không độc, trả lại nguồn nước sạch cho môi trường.
• Xem thêm:
Bài 1 trang 29 Hoá 11 SGK Chân trời sáng tạo: Liên kết hóa học trong phân tử NH3 là liên kết...
Đánh giá & nhận xét
-
 Giải bài 4 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 39 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 39 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 34 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 34 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 5 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 5 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 29 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 29 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 23 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 23 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 23 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 23 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 23 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 23 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 5 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 5 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 19 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 19 Hoá 11 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 23 SGK Chân trời sáng tạo
Giải Hóa 11 trang 23 SGK Chân trời sáng tạo
-
 Giải bài 5 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 5 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 11 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 11 Hoá 11 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 90 Chân trời sáng tạo SGK
Giải Hóa 11 trang 90 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 88 Chân trời sáng tạo SGK
Giải Hóa 11 trang 88 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 73 SGK Chân trời sáng tạo
Giải Hóa 11 trang 73 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 66 Chân trời sáng tạo SGK
Giải Hóa 11 trang 66 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 67 Chân trời sáng tạo SGK
Giải Hóa 11 trang 67 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 41 Chân trời sáng tạo SGK
Giải Hóa 11 trang 41 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 91 SGK Chân trời sáng tạo
Giải Hóa 11 trang 91 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 89 Chân trời sáng tạo SGK
Giải Hóa 11 trang 89 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 87 Chân trời sáng tạo SGK
Giải Hóa 11 trang 87 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 86 Chân trời sáng tạo SGK
Giải Hóa 11 trang 86 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 85 Chân trời sáng tạo SGK
Giải Hóa 11 trang 85 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 84 SGK Chân trời sáng tạo
Giải Hóa 11 trang 84 SGK Chân trời sáng tạo
-
 Giải Hóa 11 trang 83 Chân trời sáng tạo SGK
Giải Hóa 11 trang 83 Chân trời sáng tạo SGK
-
 Giải Hóa 11 trang 82 Chân trời sáng tạo SGK
Giải Hóa 11 trang 82 Chân trời sáng tạo SGK






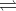 2NH3(g)
2NH3(g) 











































