Tính chất hoá học của Đồng (Cu), Đồng oxit và hợp chất của Đồng - hoá 12 bài 35
Đồng - Cu cũng là một trong những kim loại được ứng dụng rộng rãi trong thực tế, đồng có màu đỏ, dẻo, dễ kéo sợi, dát mỏng, dẫn điện và nhiệt tốt chỉ kém bạc.
Trong bài viết này, chúng ta cùng tìm hiểu tính chất vật lý và tính chất hoá học của đồng, cách điều chế đồng và một số ứng dụng phổ biến của đồng một cách chi tiết, đồng thời vận dụng giải một số bài tập về đồng.
I. Vị trí của Đồng - Cu trong bảng HTTH
- Cấu hình e nguyên tử:
29Cu: 1s22s22p63s23p63d104s1.
- Vị trí: ô 29, chu kỳ 4, nhóm IB.
- Cấu hình e của các ion:
Cu+: 1s22s22p63s23p63d10
Cu2+: 1s22s22p63s23p63d9
II. Tính chất vật lý và trạng thái tự nhiên của Đồng - Cu
1. Tính chất vật lý của Đồng
- Đồng có mạng tinh thể lập phương tâm diện, màu đỏ, dẻo, dễ kéo sợi, dát mỏng. Dẫn điện và nhiệt tốt chỉ kém bạc, t0nc = 10830C, D = 8,98 g/cm3.
2. Trạng thái tự nhiên của Đồng
- Đồng có 29 đồng vị là 63Cu và 65Cu là đồng vị bền, với 63Cu chiếm khoảng 69% đồng có mặt trong tự nhiên. Đồng có thể tìm thấy như là đồng tự nhiên hoặc trong dạng khoáng chất.
- Có nhiều dạng khoáng chứa đồng như cacbonat azurit 2CuCO3Cu(OH)2 và malachit CuCO3Cu(OH)2 là các nguồn để sản xuất đồng, cũng như là các sulfua như chalcopyrit (CuFeS2), bornit (Cu5FeS4), covellit (CuS), chalcocit (Cu2S) và các ôxít như cuprit (Cu2O).

III. Tính chất hoá học của Đồng
- Đồng có tính khử yếu: Cu → Cu2+ + 2e
1. Đồng tác dụng với phi kim
+ Đồng tác dụng với Oxi: Cu + O2
- Với oxi tạo màng CuO bảo vệ: 2Cu + O2 → 2CuO
- Ở 800 - 10000C: CuO + Cu → Cu2O
+ Đồng tác dụng với Clo: Cu + Cl2
- Với clo: Cu + Cl2 → CuCl2
- Với lưu huỳnh: Cu + S → CuS
2. Đồng tác dụng với axit
a) Đồng (Cu) không phản ứng với axit HCl, H2SO4 loãng (axit oxi hoá yếu)
- Cu không phản ứng với các axit không có tính oxi hoá mạnh.
- Khi có O2, phản ứng lại xảy ra:
2Cu + 4H+ + O2 → 2Cu2+ + 2H2O
b) Đồng (Cu) phản ứng với axit HNO3 và H2SO4 đặc nóng (axit oxi hoá mạnh)
+ Đồng tác dụng với axit Nitric: Cu+ HNO3
Cu + 4HNO3 đặc, nóng → Cu(NO3)2 + 2NO2↑ + 2H2O
+ Đồng tác dụng với axit Sunfuric: Cu+ H2SO4
Cu + 2H2SO4 đặc,nóng → CuSO4 + SO2↑ + 2H2O
3. Đồng tác dụng với dung dịch muối
+ Đồng tác dụng với AgNO3: Cu+ AgNO3
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
+ Đồng tác dụng với Fe2(SO4)3 : Fe+ Fe2(SO4)3
Cu + 2Fe3+ → Cu2+ + 2Fe2+
- Lưu ý với muối nitrat trong môi trường axit:
3Cu + 8H++ 2NO3- → 3Cu2++2NO↑ + 4H2O
IV. Hợp chất của Đồng
1. Hợp chất đồng (I)
a) Đồng (I) oxit - Cu2O
- Là chất rắn màu đỏ gạch, không tan trong nước.
- Tính chất hoá học:
+ Tác dụng với axit:
Cu2O + 2HCl → CuCl2 + H2O + Cu↓
+ Dễ bị khử:
Cu2O + H2 → 2Cu↓ + H2O
b) Đồng (I) hidroxit - Cu(OH)
- Là chất kết tủa màu vàng.
- Tính chất hoá học: Dễ bị phân hủy:
2CuOH → Cu2O + H2O
2. Hợp chất đồng (II)
a) Đồng (II) oxit - CuO
- Là chất rắn, màu đen, không tan.
- Tính chất hoá học:
+ Là oxit bazơ:
CuO + 2HCl → CuCl2 + H2O
+ Là chất oxi hóa:
CuO + H2 → Cu + H2O
CuO + C2H5OH → CH3CHO + Cu + H2O
3CuO + 2NH3 → 3Cu + N2 + 3H2O
- Điều chế đồng (II) oxit:
Cu(OH)2 → CuO + H2O
CuCO3.Cu(OH)2 → 2CuO + H2O + CO2
2Cu(NO3)2 → 2CuO + 4NO2 + O2
b) Đồng (II) hidroxit - Cu(OH)2
- Là chất kết tủa màu xanh.
- Tính chất hoá học:
+ Là bazơ không tan:
* Tác dụng với axit:
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
* Dễ nhiệt phân:
Cu(OH)2 → CuO + H2O
+ Dễ tạo phức:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
+ Là chất oxi hóa:
2Cu(OH)2 + R-CHO → R - COOH + Cu2O + 2H2O
- Điều chế đồng (II) hidroxit:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2
c) Muối Đồng (II)
- Các dung dịch muối đồng (II) đều có màu xanh.
- Tính chất hoá học:
+ Tác dụng với kiềm:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2
+ Tác dụng với dung dịch NH3:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 + (NH4)2SO4
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
+ CuSO4 hấp thụ nước thường dùng phát hiện vết nước trong chất lỏng:
CuSO4 + 5H2O → CuSO4.5H2O (màu xanh)
V. Điều chế Đồng
- Hầu hết quặng thương mại là các loại đồng sulfua, đặc biệt là chalcopyrit (CuFeS2) và ít hơn là chalcocit (Cu2S). Các khoáng này được tách ra từ các quặng được nghiền để nâng hàm lượng lên 10–15% đồng bằng froth flotation hay bioleaching. Nung vật liệu này với silica trong flash smelting để loại sắt ở dạng xỉ.
- Quá trình này khai thác dễ dàng chuyển sắt sulfua thành dạng ôxit của nó, sau đó các ôxit này phản ứng với silica để tạo ra xỉ silicat nổi lên trên khối nóng chảy. Sản phẩm tạo racopper matte chứa Cu2S sau đó được roasted để chuyển tất cả các sulfua thành ôxit.
2Cu2S + 3O2 → 2Cu2O + 2SO2↑
- Oxit đồng được chuyển thành đồng blister theo phản ứng nung
2Cu2O 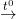 4Cu + O2↑
4Cu + O2↑
VI. Ứng dụng của Đồng
- Đồng là vật liệu dễ dát mỏng, dễ uốn, có khả năng dẫn điện và dẫn nhiệt tốt, vì vậy nó được sử dụng một cách rộng rãi trong sản xuất các sản phẩm: Dây điện; Que hàn đồng; Tay nắm và các đồ vật khác trong xây dựng nhà cửa; Động cơ, đặc biệt là các động cơ điện;.v.v.
VII. Bài tập vận dụng Đồng và hợp chất của Đồng
* Bài 1 trang 158 SGK Hóa 12: Cấu hình electron của Cu2+ là:
A. [Ar]3d7. B. [Ar]3d8.
C. [Ar]3d9. D. [Ar]3d10.
>> Giải bài 1 trang 158 SGK Hóa 12
* Bài 2 trang 159 SGK Hóa 12: Cho 19,2g kim loại M tác dụng với dung dịch HNO3 loãng dư thu được 4,48 lít khí duy nhất NO(đktc). Kim loại M là:
A. Mg. B. Cu.
C. Fe. D. Zn.
>> Giải bài 2 trang 159 SGK Hóa 12
* Bài 3 trang 159 SGK Hóa 12: Cho 7,68 gam Cu tác dụng hết với dung dịch HNO3 loãng thấy có khí NO thoát ra. Khối lượng muối nitrat sinh ra trong dung dịch là:
A. 21,56 gam.
B. 21,65 gam.
C. 22,56 gam.
D. 22,65 gam.
>> Giải bài 3 trang 159 SGK Hóa 12
* Bài 4 trang 159 SGK Hóa 12: Đốt 12,8 gam Cu trong không khí, hòa tan chất rắn thu được trong dung dịch HNO3 0,5M thấy thoát ra 448ml khí NO duy nhất (đktc).
a) Viết phương trình phản ứng hóa học xảy ra.
b) Tính thể tích tối thiểu dung dịch HNO3 cần dùng để hòa tan chất rắn.
>> Giải bài 4 trang 159 SGK Hóa 12
* Bài 5 trang 159 SGK Hóa 12: Hòa tan 58g muối CuSO4.5H2O vào nước được 500ml dung dịch A.
a) Xác định nồng độ mol của dung dịch A.
b) Cho dần dần bột sắt vào 50ml dung dịch A, khuẩy nhẹ cho tới khi dung dịch hết màu xanh. Tính lượng sắt đã tham gia phản ứng.
>> Giải bài 5 trang 159 SGK Hóa 12
* Bài 6 trang 159 SGK Hóa 12: Một thanh đồng nặng 140,8 gam sau khi đã ngâm trong dung dịch AgNO3 có khối lượng là 171,2 gam. Tính thể tích dung dịch AgNO3 32% (D= 1,2g/ml) đã tác dụng với thanh đồng.
Hy vọng với bài viết hệ thống lại tính chất hoá học của đồng, các hợp chất của đồng như đồng oxit,... giúp ích cho các em. Mọi thắc mắc các em hãy để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
» Mục lục sách giáo khoa SGK Hóa học 12 Lý thuyết và Bài tập
Đánh giá & nhận xét


-
 Giải bài 4 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 49 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 49 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 80 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 80 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 4 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 109 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 109 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 54 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 54 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 54 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 54 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 114 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 114 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 90 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 90 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 84 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 84 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 119 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 119 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK


















































