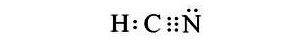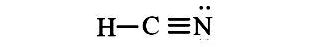Công thức Electron của HCN, Công thức Lewis và CTCT của HCN
Hướng dẫn cách viết công thức Electron của HCN, CTCT và công thức Lewis của HCN (Hydrogen Cyanide) và các nguyên tố hóa học theo chương trình SGK mới cực dễ hiểu.
Bài viết này hướng dẫn cách viết công thức Electron của HCN , công thức Lewis và CTCT của HCN (Hydrogen Cyanide) từng bước, cụ thể, dễ hiểu dành cho các em.
1. Công thức Electron của HCN (Hydrogen Cyanide)
Sự tạo thành phân tử HCN:
Nguyên tử H có 1 electron hóa trị, cần thêm 1 electron để đạt octet.
Nguyên tử C có 4 electron hóa trị, cần thêm 4 electron để đạt octet.
Nguyên tử N có 5 electron hóa trị, cần thêm 3 electron để đạt octet.
Trong phân tử HCN, nguyên tử C góp chung 1 electron để tạo thành 1 cặp electron dùng chung với nguyên tử H. Nguyên tử C góp chung 3 electron với nguyên tử N để tạo thành 3 cặp electron dùng chung giữa C và N.
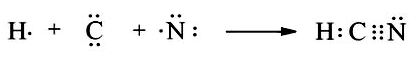
Vậy công thức electron của HCN là:
2. Viết Công thức lewis HCN (dựa vào công thức electron)
Từ công thức electron, thay 1 cặp electron dùng chung bằng 1 gạch nối “–” giữa hai nguyên tử ta được công thức Lewis
Từ công thức electron của HCN, thay mỗi cặp electron bằng một gạch nối. Ta được:
Công thức Lewis của HCN là:
3. Viết công thức Lewis của HCN (theo công thức phân tử và electron hoá trị)
Thực hiện lần lượt theo các bước sau:
• Bước 1: Tính tổng số electron hóa trị trong phân tử
H có 1 electron hóa trị, C có 4 electron hóa trị, N có 5 electron hóa trị. Trong phân tử HCN có 1 nguyên tử H, 1 nguyên tử C và 1 nguyên tử N.
Vậy tổng số electron hóa trị = 1.1 + 4.1 + 5.1 = 10 electron.
• Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
Trong phân tử HCN, trừ H thì nguyên tử C cần nhiều electron hơn để đạt octet. Vì vậy, C là nguyên tử trung tâm còn các nguyên tử N được xếp xung quanh:
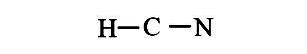
• Bước 3: Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là:
10 – 2.2 = 6 electron
Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn trong sơ đồ.
Trong công thức bước 2, nguyên tử H đã đạt octet, xung quanh nguyên tử N mới có 2 electron nên cần phải bổ sung 6 electron vào nguyên tử này. Ta được công thức sau:
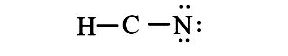
Nếu electron hóa trị còn dư, đặt số electron hóa trị dư trên nguyên tử trung tâm. Kiểm tra nguyên tử trung tâm đã đạt quy tắc octet chưa.
Nếu số electron hóa trị không còn dư mà nguyên tử trung tâm chưa đạt quy tắc octet, chuyển sang Bước 4.
Số electron hóa trị còn lại = 6 – 6 = 0
Nguyên tử trung tâm C có 4 electron hóa trị, chưa đạt octet.
• Bước 4: Chuyển cặp electron chưa liên kết trên nguyên tử xung quanh thành electron liên kết sao cho nguyên tử trung tâm thỏa mãn quy tắc octet.
Vì C chưa đạt octet, cần chuyển hai cặp electron của nguyên tử N thành cặp electron chung giữa C và N để C đạt octet.
Vậy Công thức Lewis của HCN là:
* Nhận xét:
° ∆χ(C – H) = |2,55 – 2,2| = 0,35 < 0,4 ⇒ liên kết C – H trong phân tử HCNthuộc loại liên kết cộng hóa trị không phân cực.
° ∆χ(C ≡N) = |2,55 – 3,04| = 0,49 > 0,4 ⇒ liên kết C ≡N trong phân tử HCNthuộc loại liên kết cộng hóa trị phân cực. Phân tử phân cực về phía nguyên tử N.
4. Công thức cấu tạo (CTCT) của HCN (Hydrogen Cyanide)
Từ công thức Lewis, ta loại bỏ đi các electron tự do (electron không tham gia liên kết) thu được công thức cấu tạo.
Công thức cấu tạo của HCN là:
![]()
* Nhận xét:
° Phân tử HCN có một liên kết đơn C – H và một liên kết ba C ≡ N (trong mỗi liên kết ba có 1 liên kết σ và 2 liên kết π).
° Phân tử HCN có cấu tạo thẳng.
» Xem để hiểu cách viết Công thức E, Công thức Lewis và CTCT
| Công thức Electron, Công thức Lewis của: | ||||
| SF4 | BH3 | CO2 | C2H2 | CH4 |
| H2CO3 | HClO | HClO2 | CS2 | HCN |
Hy vọng với bài viết về cách viết Công thức Electron của HCN, Công thức Lewis và CTCT của HCN (Hydrogen Cyanide) ở trên giúp các em hiểu rõ hơn về cấu trúc Lewis. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tốt.
Đánh giá & nhận xét
-
 Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa học 10 trang 20 - Kết nối tri thức
Giải Hóa học 10 trang 20 - Kết nối tri thức
-
 Giải Hóa học 10 trang 18 - Kết nối tri thức
Giải Hóa học 10 trang 18 - Kết nối tri thức
-
 Giải Hóa học 10 trang 17 - Kết nối tri thức
Giải Hóa học 10 trang 17 - Kết nối tri thức
-
 Giải Hóa học 10 trang 16 - Kết nối tri thức
Giải Hóa học 10 trang 16 - Kết nối tri thức
-
 Giải Hóa học 10 trang 15 - Kết nối tri thức
Giải Hóa học 10 trang 15 - Kết nối tri thức
-
 Giải Hóa học 10 trang 14 - Kết nối tri thức
Giải Hóa học 10 trang 14 - Kết nối tri thức
-
 Giải Hóa học 10 trang 13 - Kết nối tri thức
Giải Hóa học 10 trang 13 - Kết nối tri thức
-
 Giải Hóa học 10 trang 8 - Kết nối tri thức
Giải Hóa học 10 trang 8 - Kết nối tri thức
-
 Giải Hóa học 10 trang 7 - Kết nối tri thức
Giải Hóa học 10 trang 7 - Kết nối tri thức
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK