Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
Sodium oxide ($Na_2O$) là một oxit bazơ quan trọng, đóng vai trò chất trợ nóng chảy trong công nghiệp sản xuất thủy tinh và gốm sứ. Về mặt cấu trúc hóa học, $Na_2O$ là một hợp chất ion điển hình. Việc trình bày quá trình hình thành liên kết trong phân tử này không chỉ giúp chúng ta hiểu về cấu tạo chất mà còn giải thích được các đặc tính vật lí như nhiệt độ nóng chảy cao và tính dẫn điện của nó.
Bài 5 trang 58 SGK Hoá 10 (Chân trời sáng tạo):
Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Trình bày sự hình thành liên kết ion trong phân tử sodium oxide.
Phân tích và Hướng dẫn giải
Để trình bày sự hình thành liên kết ion, chúng ta cần thực hiện qua 3 bước cốt lõi:
-
Viết cấu hình electron và xác định xu hướng nhường/nhận electron của từng nguyên tử.
-
Mô tả quá trình nhường/nhận electron để hình thành các ion (Cation và Anion).
-
Mô tả lực hút tĩnh điện giữa các ion trái dấu tạo nên hợp chất.
Giải bài 5 trang 58 SGK Hoá 10 (Chân trời sáng tạo):
- Nguyên tử Na (Z = 11): 1s22s22p63s1 ⇒ Có 1 electron ở lớp ngoài cùng
⇒ Có xu hướng nhường 1 electron để đạt cấu hình electron của khí hiếm tạo thành ion Na+
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron ở lớp ngoài cùng
⇒ Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2-
⇒ Nguyên tử O nhận 2 electron của hai nguyên tử Na tạo thành ion là O2-.
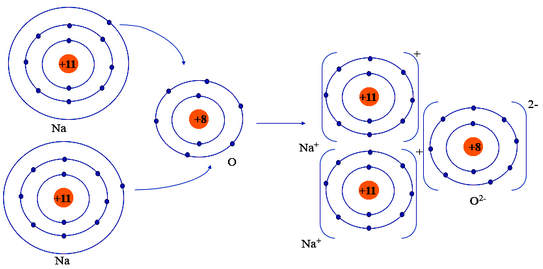
- Hai ion Na+ và 1 ion O2- liên kết với nhau tạo thành phân tử Na2O.
Qua lời giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo, các em cần nhớ:
-
Bản chất liên kết: Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
-
Đặc điểm: Liên kết ion thường được tạo thành giữa các nguyên tử kim loại điển hình (như $Na$) và phi kim điển hình (như $O$).
-
Lưu ý: Luôn đảm bảo tổng số electron nhường bằng tổng số electron nhận để phân tử trung hòa về điện.
• Xem thêm:
Đánh giá & nhận xét
-
 Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
Giải Hóa 10 trang 77 Chân trời sáng tạo SGK


















































