Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Chào các em! Hôm nay chúng ta sẽ cùng nhau giải chi tiết Bài 1 trang 34 SGK Hóa 10 thuộc bộ sách Chân trời sáng tạo. Bài tập này giúp các em ôn lại quy tắc quan trọng trong việc sắp xếp electron vào các orbital: quy tắc Hund.
Đề bài:
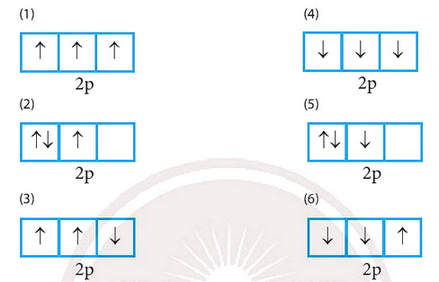
Trong các cách biểu diễn electron vào các orbital của phân lớp 2p ở trạng thái cơ bản, hãy chọn cách phân bố đúng:
Phân tích và Hướng dẫn giải:
Để xác định cách biểu diễn electron đúng trong một phân lớp, chúng ta cần tuân theo hai nguyên tắc chính:
-
Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron, và hai electron này phải có chiều tự quay ngược nhau.
-
Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ có xu hướng phân bố vào các orbital sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau. Chiều tự quay của các electron độc thân thường được biểu diễn bằng mũi tên hướng lên (↑).
Phân lớp 2p có 3 orbital, và chúng ta cần xét các trường hợp phân bố electron sao cho tuân thủ cả hai nguyên tắc trên.
Lời giải chi tiết:
Chọn (1) thỏa mãn vì chứa tối đa electron độc thân, các electron độc thân được biểu diễn bằng mũi tên hướng lên trên.
(2) sai vì chưa thỏa mãn số electron độc thân là tối đa.
(3) sai vì electron độc thân phải được biểu diễn bằng mũi tên hướng lên trên.
(4) sai vì electron độc thân phải được biểu diễn bằng mũi tên hướng lên trên.
(5) sai vì chưa thỏa mãn số electron độc thân là tối đa và electron độc thân phải được biểu diễn bằng mũi tên hướng lên trên.
(6) sai vì electron độc thân phải được biểu diễn bằng mũi tên hướng lên trên.
Qua bài tập này, các em đã củng cố kiến thức về quy tắc Hund. Quy tắc này là nền tảng để viết cấu hình electron của nguyên tử, giúp chúng ta hiểu được cách các electron sắp xếp trong các orbital. Hãy luôn nhớ rằng, electron có xu hướng chiếm các orbital trống trước khi ghép đôi và các electron độc thân phải có chiều tự quay giống nhau.
• Xem thêm:
Đánh giá & nhận xét
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 76 Chân trời sáng tạo SGK
Giải Hóa 10 trang 76 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 75 Chân trời sáng tạo SGK
Giải Hóa 10 trang 75 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 74 Chân trời sáng tạo SGK
Giải Hóa 10 trang 74 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 73 Chân trời sáng tạo SGK
Giải Hóa 10 trang 73 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 72 Chân trời sáng tạo SGK
Giải Hóa 10 trang 72 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 71 Chân trời sáng tạo SGK
Giải Hóa 10 trang 71 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 70 Chân trời sáng tạo SGK
Giải Hóa 10 trang 70 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 69 Chân trời sáng tạo SGK
Giải Hóa 10 trang 69 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 68 Chân trời sáng tạo SGK
Giải Hóa 10 trang 68 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 67 Chân trời sáng tạo SGK
Giải Hóa 10 trang 67 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 66 Chân trời sáng tạo SGK
Giải Hóa 10 trang 66 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 65 Chân trời sáng tạo SGK
Giải Hóa 10 trang 65 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 64 Chân trời sáng tạo SGK
Giải Hóa 10 trang 64 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 63 Chân trời sáng tạo SGK
Giải Hóa 10 trang 63 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 62 Chân trời sáng tạo SGK
Giải Hóa 10 trang 62 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 61 Chân trời sáng tạo SGK
Giải Hóa 10 trang 61 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 60 Chân trời sáng tạo SGK
Giải Hóa 10 trang 60 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 59 Chân trời sáng tạo SGK
Giải Hóa 10 trang 59 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 58 Chân trời sáng tạo SGK
Giải Hóa 10 trang 58 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 57 Chân trời sáng tạo SGK
Giải Hóa 10 trang 57 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 56 Chân trời sáng tạo SGK
Giải Hóa 10 trang 56 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 55 Chân trời sáng tạo SGK
Giải Hóa 10 trang 55 Chân trời sáng tạo SGK


















































