Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Chào các em! Hôm nay chúng ta sẽ cùng nhau giải chi tiết Bài 3 trang 34 SGK Hóa 10 thuộc bộ sách Chân trời sáng tạo. Bài tập này giúp các em ôn lại cách xác định electron độc thân của các nguyên tố dựa vào cấu hình electron của chúng ở trạng thái cơ bản.
Đề bài:
Ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có electron độc thân?
a) Boron
b) Oxygen
c) Phosphorus
d) Chlorine
Phân tích và Hướng dẫn giải:
Để xác định một nguyên tử có electron độc thân hay không, các em cần làm theo các bước sau:
-
Xác định số hiệu nguyên tử (Z) của mỗi nguyên tố.
-
Viết cấu hình electron của nguyên tử đó ở trạng thái cơ bản.
-
Vẽ các orbital cho phân lớp có năng lượng cao nhất (lớp ngoài cùng hoặc phân lớp cuối cùng được điền electron).
-
Áp dụng quy tắc Hund để phân bố electron vào các orbital: Các electron sẽ điền vào các orbital trống trước (mỗi orbital một electron) với chiều tự quay giống nhau, sau đó mới bắt đầu ghép đôi.
Electron độc thân là những electron đứng một mình trong một orbital. Nếu có bất kỳ orbital nào chứa một electron, thì nguyên tử đó có electron độc thân.
Lời giải chi tiết:
Ở trạng thái cơ bản, nguyên tử của tất cả các nguyên tố trên đều chứa electron độc thân.
+ Nguyên tử Boron (Z = 5)
Cấu hình electron: 1s22s22p1
Orbital lớp ngoài cùng: 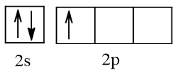
Số electron độc thân: 1
+ Nguyên tử Oxygen (Z = 8)
Cấu hình electron: 1s22s22p4
Orbital lớp ngoài cùng: 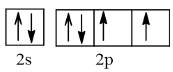
Số electron độc thân: 2
+ Nguyên tử Phosphorus (Z = 15)
Cấu hình electron: 1s22s22p63s23p3
Orbital lớp ngoài cùng: 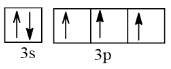
Số electron độc thân: 3
+ Nguyên tử Chlorine (Z = 17)
Cấu hình electron: 1s22s22p63s23p5
Orbital lớp ngoài cùng: 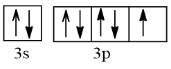
Số electron độc thân: 1
Qua bài tập này, các em đã rèn luyện kỹ năng xác định electron độc thân bằng cách viết cấu hình electron và áp dụng quy tắc Hund. Việc nắm vững quy tắc này là rất quan trọng để hiểu tính chất hóa học và sự hình thành liên kết của các nguyên tố.
• Xem thêm:
Đánh giá & nhận xét
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 76 Chân trời sáng tạo SGK
Giải Hóa 10 trang 76 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 75 Chân trời sáng tạo SGK
Giải Hóa 10 trang 75 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 74 Chân trời sáng tạo SGK
Giải Hóa 10 trang 74 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 73 Chân trời sáng tạo SGK
Giải Hóa 10 trang 73 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 72 Chân trời sáng tạo SGK
Giải Hóa 10 trang 72 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 71 Chân trời sáng tạo SGK
Giải Hóa 10 trang 71 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 70 Chân trời sáng tạo SGK
Giải Hóa 10 trang 70 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 69 Chân trời sáng tạo SGK
Giải Hóa 10 trang 69 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 68 Chân trời sáng tạo SGK
Giải Hóa 10 trang 68 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 67 Chân trời sáng tạo SGK
Giải Hóa 10 trang 67 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 66 Chân trời sáng tạo SGK
Giải Hóa 10 trang 66 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 65 Chân trời sáng tạo SGK
Giải Hóa 10 trang 65 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 64 Chân trời sáng tạo SGK
Giải Hóa 10 trang 64 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 63 Chân trời sáng tạo SGK
Giải Hóa 10 trang 63 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 62 Chân trời sáng tạo SGK
Giải Hóa 10 trang 62 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 61 Chân trời sáng tạo SGK
Giải Hóa 10 trang 61 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 60 Chân trời sáng tạo SGK
Giải Hóa 10 trang 60 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 59 Chân trời sáng tạo SGK
Giải Hóa 10 trang 59 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 58 Chân trời sáng tạo SGK
Giải Hóa 10 trang 58 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 57 Chân trời sáng tạo SGK
Giải Hóa 10 trang 57 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 56 Chân trời sáng tạo SGK
Giải Hóa 10 trang 56 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 55 Chân trời sáng tạo SGK
Giải Hóa 10 trang 55 Chân trời sáng tạo SGK


















































