Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
Liên kết hydrogen (hydrogen bonding) là tương tác tĩnh điện giữa nguyên tử hydrogen linh động (liên kết với nguyên tử có độ âm điện lớn) với các nguyên tử có độ âm điện lớn khác còn cặp electron hóa trị chưa tham gia liên kết. Việc biểu diễn chính xác liên kết này bằng các dấu ba chấm ($\cdots$) là kỹ năng quan trọng để giải thích các tính chất vật lí như nhiệt độ sôi và độ tan của các hợp chất hữu cơ và vô cơ.
Bài 4 trang 71 SGK Hoá 10 (Chân trời sáng tạo):
Biểu diễn liên kết hydrogen giữa các phân tử:
a) Hydrogen fluoride
b) Ethanol (C2H5OH) và nước
Phân tích và Hướng dẫn giải
1. Quy ước biểu diễn
-
Liên kết cộng hóa trị giữa các nguyên tử trong phân tử được biểu diễn bằng nét gạch liền (—).
-
Liên kết hydrogen giữa các phân tử được biểu diễn bằng dấu ba chấm ($\cdots$).
-
Nguyên tử $H$ trong liên kết hydrogen phải nằm giữa hai nguyên tử có độ âm điện lớn (thường là $F, O, N$).
2. Các ký hiệu điện tích riêng phần
-
Nguyên tử $H$ mang điện tích dương riêng phần ($\delta^+$).
-
Nguyên tử có độ âm điện lớn ($F, O$) mang điện tích âm riêng phần ($\delta^-$).
Giải bài 4 trang 71 SGK Hoá 10 (Chân trời sáng tạo):
a) Liên kết hydrogen được hình thành giữa các phân tử HF:
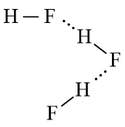
b) Liên kết hydrogen được hình thành giữa H2O và C2H5O
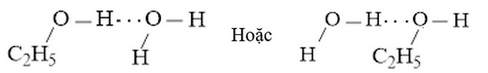
Qua lời giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo, các em cần nhớ:
-
Vai trò: Liên kết hydrogen giải thích tại sao $HF$ có nhiệt độ sôi cao hơn các hydrogen halide khác và tại sao các rượu đơn chức như ethanol lại tan tốt trong nước.
-
Đặc điểm: Liên kết hydrogen yếu hơn liên kết cộng hóa trị nhưng mạnh hơn lực Van der Waals thông thường.
• Xem thêm:
Bài 3 trang 71 SGK Hoá 10 (Chân trời sáng tạo): Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?..
Đánh giá & nhận xét
-
 Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
Giải Hóa 10 trang 77 Chân trời sáng tạo SGK


















































