Liên kết cộng hóa trị là gì, Liên kết cộng hóa trị có cực và không cực - hóa 10 bài 13
Liên kết cộng hóa trị là liên kết được hình thành giữa 2 nguyên tử bằng 1 hay nhiều cặp electron dùng chung, liên kết cộng hóa trị có 2 loại là có cực hoặc không cực.
Vậy liên kết cộng hóa trị có cực và không cực khác nhau thế nào? chúng được hình thành trong phân tử đơn chất và hợp chất như thế nào? Và làm sao để phân loại liên kết hóa học theo độ âm điện, chúng ta cùng tìm hiểu qua bài này.
I. Sự hình thành liên kết cộng hóa trị
1. Liên kết cộng hóa trị hình thành giữa các nguyên tử giống nhau
* Sự hình thành đơn chất.
a) Sự hình thành phân tử Hidro (H2).
- Hidro (H): 1s1 và Heli (He): 1s2
- Nguyên tử H (Z=1) có cấu hình electron là 1s1, hai nguyên tử H liên kết với nhau bằng cách mỗi nguyên tử H góp 1 electron tạo thành một cặp electron chung trong phân tử H2. Như thế trong phân tử H2, mỗi phân tử có 2 electron, giống cấu hình electron bền vững của khí hiếm heli:
![]()
- Mỗi chấm bên kí hiệu nguyên tố biểu diễn một electron ở lớp ngoài cùng.
- Ký hiệu H:H là công thức electron; H-H là công thức cấu tạo.
- Giữa 2 nguyên tử Hidro có 1 cặp electron liên kết biểu thị bằng (-) đó là liên kết đơn.
b) Sự hình thành phân tử Nito (N2).
- Nito (N): 1s22s22p3 và Neon (Ne): 1s22s22p6
- Cấu hình electron nguyên tử của N (Z=7) là 1s22s22p3, có 5 electron ở lớp ngoài cùng. Trong phân tử nitơ N2, để đạt cấu hình electron của nguyên tử khí hiếm gần nhất Ne, mỗi nguyên tử nitơ phải góp chung 3 electron.
![]()
- Ký hiệu:N
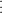 N: là công thức electron; N≡N là công thức cấu tạo.
N: là công thức electron; N≡N là công thức cấu tạo.
- Hai nguyên tử N liên kết với nhau bằng 3 cặp electron liên kết biểu thị bằng 3 gạch (≡), đó là liên kết ba, liên kết 3 bền hơn liên kết đôi.
c) Liên kết cộng hóa trị là gì?
- Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
- Mỗi cặp electron chung tạo nên 1 liên kết cộng hoá trị, nên ta có liên kết đơn (trong phân tử H2), liên kết ba (trong phân tử N2).
* Liên kết cộng hóa trị không phân cực:
- Là liên kết tạo nên từ 2 nguyên tử của cùng 1 nguyên tố (phân tử H2, N2 có cùng độ âm điện), do đó liên kết trong các phân tử đó không phân cực. Đó là liên kết cộng hoá trị không phân cực.

2. Liên kết cộng hóa trị hình thành giữa các nguyên tử khác nhau
* Sự hình thành hợp chất
a) Sự hình thành phân tử hidro clorua HCl
- Mỗi nguyên tử H và Cl góp 1 electron tạo thành 1 cặp electron chung để tạo thành 1 liên kết cộng hoá trị.
- Độ âm điện của clo là 3,16 lớn hơn độ âm điện của hiđro là 2,20 nên cặp electron liên kết bị lệch về phía clo, liên kết cộng hóa trị này bị phân cực.
![]()
- Công thức cấu tạo H-Cl; Công thức electron H:Cl
* Liên kết cộng hóa trị có phân cực:
- Là liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
- Trong công thức electron của phân tử có cực, người ta đặt cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.
b) Sự hình thành phân tử Cacbon dioxit (Cacbonic) CO2
- Cấu hình electron nguyên tử của C(Z=6) là 1s22s22p2, nguyên tử cacbon có 4 electron ở lớp ngoài cùng.
- Cấu hình electron nguyên tử của O(Z=8) là 1s22s22p4, nguyên tử oxi có 6 electron ở lớp ngoài cùng.
- Trong phân tử CO2, nguyên tử C nằm giữa 2 nguyên tử O và góp chung với mỗi nguyên tử O hai electron. Mỗi nguyên tử O góp chung với nguyên tử C hai electron tạo ra 2 liên kết đôi.
- Ta có O::C::O là công thức electron ; O=C=O là công thức cấu tạo.
- Như vậy, mỗi nguyên tử C hay O đều có 8 electron ở lớp ngoài cùng, đạt cấu hình bền vững của khí hiếm.
- Độ âm điện của oxi (3,14) lớn hơn độ âm điện của C(2,55) nên cặp electron chung lệch về phía Oxi. Liên kết giữa hai nguyên tử oxi và cacbon là phân cực, nhưng phân tử CO2 có cấu tạo thẳng nên 2 liên kết đôi phân cực (C=O) triệt tiêu nhau, kết quả là phân tử CO2 không bị phân cực.
3. Tính chất của các chất có liên kết cộng hóa trị
- Các chất mà phân tử chỉ có liên kết cộng hóa trị có thể là chất rắn như đường, lưu huỳnh, iot,... có thể là chất lỏng: nước, ancol,... hoặc chất khí như khí cacbonic, clo, hiđro,...
- Các chất có cực như ancol etylic, đường,... tan nhiều trong dung môi có cực như nước. Phần lớn các chất không cực như iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen, cacbon tetraclorua,...
- Nói chung, các chất chỉ có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
II. Độ âm điện và Liên kết hóa học
1. Quan hệ giữa liên kết cộng hóa trị có cực, liên kết cộng hóa trị không cực và liên kết ion
- Trong phân tử, nếu cặp electron chung ở giữa 2 nguyên tử ta có liên kết cộng hoá trị không cực.
- Nếu cặp electron chung lệch về 1 phía của nguyên tử (có giá trị độ âm điện lớn hơn) thì đó là liên kết cộng hoá trị có cực.
- Nếu cặp electron chung lệch hẳn về 1 nguyên tử, ta sẽ có liên kết ion. Như vậy, liên kết ion có thể coi là trường hợp riêng của liên kết cộng hóa trị.
2. Hiệu độ âm điện và liên kết hóa học
- Để đánh giá loại liên kết trong phân tử hợp chất, người ta có thể dựa vào hiệu độ âm điện. Cách phân loại một cách tương đối theo thang độ âm điện của Pau - Linh như sau:
| Hiệu độ âm điện | Liên kết |
| từ 0 đến <0,4 | Liên kết cộng hóa trị không cực |
| từ 0,4 đến <1,7 | Liên kết cộng hóa trị có cực |
| ≥ 1,7 | Liên kết ion |
- Trong NaCl ta có hiệu độ âm điện: 3,16 – 0,93 = 2,23 > 1,7 liên kết giữa Na và Cl là liên kết ion.
- Trong phân tử HCl ta có hiệu độ âm điện: 3,16 – 2,2 = 0,96 ⇒ liên kết giữa H và Cl là liên kết cộng hoá trị có cực.
- Trong phân tử H2 ta có hiệu độ âm điện: 2,20 – 2,20 = 0,0 ⇒ liên kết giữa H và H là liên kết cộng hoá trị không cực.
III. Bài tập vận dụng liên kết cộng hóa trị
* Bài 1 trang 64 SGK Hóa 10: Chọn câu đúng nhất về liên kết cộng hóa trị. Liên kết cộng hóa trị là liên kết
A. Giữa các phi kim với nhau.
B. Trong đó cặp electron chung bị lệch về một nguyên tử.
C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
D. Được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
° Lời giải bài 1 trang 64 SGK Hóa 10:
- Đáp án đúng: D. Được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
* Bài 2 trang 64 SGK Hóa 10: Chọn câu đúng trong các câu sau:
A. Trong liên kết cộng hóa trị cặp electron lệch về phía nguyên tử có độ âm điện nhỏ hơn.
B. Liên kết cộng hóa trị có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
C. Liên kết cộng hóa trị không có cực được tạo nên từ các nguyên tử khác hẳn nhau về tính chất hóa học.
D. Hiệu độ âm điện giữa 2 nguyên tử lớn thì phân tử phân cực yếu.
° Lời giải bài 2 trang 64 SGK Hóa 10:
- Đáp án đúng: B. Liên kết cộng hóa trị có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
* Bài 3 trang 64 SGK Hóa 10: Độ âm điện của một nguyên tử đặc trưng cho
A. Khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
B. Khả năng nhường electron của nguyên tử đó cho nguyên tử khác.
C. Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
D. Khả năng nhường proton của nguyên tử đó cho nguyên tử khác.
Chọn đáp án đúng.
° Lời giải bài 3 trang 64 SGK Hóa 10:
- Đáp án đúng: A. Khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
* Bài 4 trang 64 SGK Hóa 10: Thế nào là liên kết ion, liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực, liên kết cộng hóa trị có cực. Cho thí dụ minh họa.
° Lời giải bài 4 trang 64 SGK Hóa 10:
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu. Thí dụ : K+ + Cl- → KCl.
- Liên kết cộng hóa trị không cực là liên kết được tạo nên giữa hai nguyên tử bằng những cặp electron chung. Thí dụ: Cl. + .Cl → Cl:Cl
- Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực. Thí dụ: H. + .Cl → H :Cl hay H –Cl.
* Bài 5 trang 64 SGK Hóa 10: Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nào trong các chất sau đậy: AlCl3, CaCl2, CaS, Al2S3? (Lấy giá trị độ âm điện của các nguyên tố ở bảng 6 trang 45).
° Lời giải bài 5 trang 64 SGK Hóa 10:
- Hiệu độ âm điện:
CaCl2: 2,16. Liên kết ion
AlCl3: 1,55. Liên kết cộng hóa trị có cực
CaS: 1,58.Liên kết cộng hóa trị có cực.
Al2S3: 0,97. Liên kết cộng hóa trị có cực.
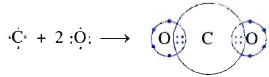
* Bài 6 trang 64 SGK Hóa 10: Viết công thức electron và công thức cấu tạo các phân tử sau: Cl2, CH4, C2H2, C2H4,NH4.
° Lời giải bài 6 trang 64 SGK Hóa 10:
- Công thức electron và công thức cấu tạo các phân tử sau:
* Bài 7 trang 64 SGK Hóa 10: X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
° Lời giải bài 7 trang 64 SGK Hóa 10:
a) 9X : 1s22s22p5 Đây là F có độ âm điện là 3,98.
19A : 1s22s22p63s23p64s1 Đây là K có độ âm điện là 0,82.
8Z: 1s22s22p4 Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16, có liên kết ion.
- Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
- Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực.
Hy vọng với bài viết về liên kết cộng hóa trị, liên kết cộng hóa trị có cực và không cực ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Hay Học Hoi ghi nhận và hỗ trợ, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét
-
 Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa học 10 trang 20 - Kết nối tri thức
Giải Hóa học 10 trang 20 - Kết nối tri thức
-
 Giải Hóa học 10 trang 18 - Kết nối tri thức
Giải Hóa học 10 trang 18 - Kết nối tri thức
-
 Giải Hóa học 10 trang 17 - Kết nối tri thức
Giải Hóa học 10 trang 17 - Kết nối tri thức
-
 Giải Hóa học 10 trang 16 - Kết nối tri thức
Giải Hóa học 10 trang 16 - Kết nối tri thức
-
 Giải Hóa học 10 trang 15 - Kết nối tri thức
Giải Hóa học 10 trang 15 - Kết nối tri thức
-
 Giải Hóa học 10 trang 14 - Kết nối tri thức
Giải Hóa học 10 trang 14 - Kết nối tri thức
-
 Giải Hóa học 10 trang 13 - Kết nối tri thức
Giải Hóa học 10 trang 13 - Kết nối tri thức
-
 Giải Hóa học 10 trang 8 - Kết nối tri thức
Giải Hóa học 10 trang 8 - Kết nối tri thức
-
 Giải Hóa học 10 trang 7 - Kết nối tri thức
Giải Hóa học 10 trang 7 - Kết nối tri thức
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK


















































