Tính chất hoá học của axit Clohidric HCl, Hiđro clorua và muối Clorua - hoá 10 bài 23
Axit Clo hidric HCl là chất lỏng không màu, dễ bay hơi trong khi đó Hiđro clorua (HCl) là chất khí, không màu, mùi xốc tan nhiều trong nước tạo thành dung dịch axit mạnh HCl.
Axit Clohidric HCl có đầy đủ tính chất hoá học chung của một axit hay không, có gì khác so với các axit sunfuric H2SO4 axit photphoric H3PO4 hay axit nitric HNO3,... chúng ta hãy cùng tìm hiểu qua bài viết này.
A. Hiđro Clorua - Axit Clo hiđric HCl
I. Tính chất vật lý của Hiđro Clorua và Axit Clohiđric HCl
- Hiđro clorua là chất khí, không màu, mùi xốc tan nhiều trong nước tạo thành dung dịch axit mạnh HCl; nặng hơn không khí.
- Axit clohđric HCl là chất lỏng không màu, dễ bay hơi. Dung dịch axit HCl không màu, HCl đặc bốc khói trong không khí ẩm.
 II. Tính chất hoá học của HiđroClorua và Axit Clo hiđric HCl
II. Tính chất hoá học của HiđroClorua và Axit Clo hiđric HCl
1. HCl có tính axit mạnh
- Làm quỳ tím chuyển thành màu đỏ.
* Lưu ý: Khí HCl không làm quỳ tím (khô) chuyển màu đỏ và không tác dụng với CaCO3,...
a) Axit Clohidric tác dụng với kim loại đứng trước H → muối trong đó kim loại có hóa trị thấp + H2.
* Chú ý: Pb đứng trước Hidro nhưng không tan trong dung dịch HCl do PbCl2 không tan.
• HCl + Fe
Fe + 2HCl → FeCl2 + H2↑
b) Axit Clohidric tác dụng với oxit kim loại → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
• HCl + Fe3O4
Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
c) Axit Clohidric tác dụng với bazơ → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
• HCl + NaOH
NaOH + HCl → NaCl + H2O
• HCl + Fe(OH)2
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
d) Axit Clohidric tác dụng với muối → muối mới + axit mới
• HCl + Na2CO3
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
• HCl + CaCO3
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
• HCl + AgNO3
AgNO3 + 2HCl → AgCl↓ trắng + HNO3
2. HCl có tính oxi hóa - khử
• Axit Clohidric thể hiện tính oxi hóa khi tác dụng với các kim loại đứng trước H2 (xem phần tính axit).
• Axit Clohidric đóng vai trò chất khử khi tác dụng với chất có tính oxi hóa mạnh như KMnO4, K2Cr2O7, MnO2, KClO3, ...
2HCl + MnO2 → MnCl2 + Cl2↑ + H2O
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
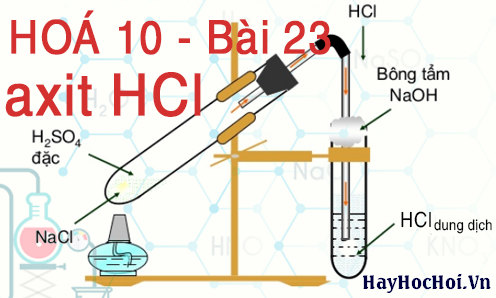
III. Điều chế axit clohiđric HCl
- Phương pháp sunfat (trong phòng thí nghiệm):
NaCl rắn + H2SO4 đặc ![small xrightarrow[]{<250^{0}C}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/1578358347w4h5z72oaf_1639446302.gif) NaHSO4 + HCl
NaHSO4 + HCl
2NaCl rắn + H2SO4 đặc ![small xrightarrow[]{>400^{0}C}](https://hayhochoi.vn/uploads/news/wyswyg/2021_12/157835834840o18c37hy_1639446302.gif) Na2SO4 + 2HCl
Na2SO4 + 2HCl
B. Muối Clorua
1. Muối Clorua MCln
- Muối của axit clohiđric được gọi là muối clorua.
- Công thức tổng quát: MCln.
- Các muối clorua hầu hết đều tan trừ PbCl2 và AgCl, CuCl, Hg2Cl2.
2. Nhận biết ion clorua Cl-
- Nhỏ dung dịch bạc nitrat vào dung dịch muối clorua hoặc dung dịch axit clohiđric sẽ có kết tủa trắng bạc clorua xuất hiện, kết tủa này không tan trong các axit mạnh.
AgNO3 + NaCl → AgCl↓ trắng + NaNO3
AgNO3 + HCl → AgCl↓ trắng + HNO3
- Vậy AgNO3 là thuốc thử để nhận biết ion clorua Cl-
C. Bài tập về Axit Clohiđric, Hidroclorua
Bài 1 trang 106 sgk hóa 10: Cho 20g hỗn hợp bột Mg và Fe tác dụng với dung dịch HCl dư thấy có 1g khí H2 bay ra. Khối lượng muối clorua tạo ra trong dung dịch là bao nhiêu gam?
A. 40,5g. B. 45,5g. C. 55,5g. D. 65,5g.
Lời giải bài 1 trang 106 sgk hóa 10:
* Đáp án: C đúng
- Theo bài ra, ta có: nH2 = m/M = 1/2 = 0,5 (mol).
- PTPƯ khi cho Mg và Fe vào dd HCl:
Mg + 2HCl → MgCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
- Giả sử: nMg = x; nFe = y.
- Theo PTPƯ ta có: nH2 = x + y = 0,5 (mol). (1)
mà theo bài ra: mhh = 24x + 56y = 20 (g). (2)
Giải hệ phương trình (1) và (2) ta có x = y =0,25 mol.
⇒ mMgCl2 = n.M = 0,25.95 = 23,75g.
⇒ mFeCl2 = n.M = 0,25.127 = 31,75g
⇒ Khối lượng muối clorua là: m = mMgCl2 + mFeCl2 = 23,75 + 31,75= 55,5
Bài 3 trang 106 sgk hóa 10: Có các chất sau: axit sunfuric đặc, nước, kali clorua rắn. Hãy viết các phương trình phản ứng để điều chế hidro clorua.
Lời giải bài 3 trang 106 sgk hóa 10:
- Phương trình hóa học của phản ứng điều chế hidro clorua
2NaCl tinh thể + H2SO4 đđ 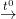 Na2SO4 + 2HCl
Na2SO4 + 2HCl
2KCl + 2H2O -đpnc, màng ngăn→ 2KOH + H2 + Cl2↑
H2 + Cl2 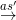 2HCl.
2HCl.
Bài 6 trang 106 sgk hóa 10: Sục khí Cl2 đi qua dung dịch Na2CO3 thấy có khí CO2 thoát ra. Hãy viết phương trình hóa học của các phản ứng đã xảy ra.
Lời giải bài 6 trang 106 sgk hóa 10:
Cl2 + H2O 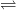 HCl + HClO
HCl + HClO
2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O.
Bài 7 trang 106 sgk hóa 10: Tính nồng độ của hai dung dịch axit clohiđric trong các trường hợp sau:
a) Cần phải dùng 150ml dung dịch HCl để kết tủa hoàn toàn 200g dung dịch AgNO3 8,5%.
b) Khi cho 50g dung dịch HCl vào một cốc đựng NaHCO3 (dư) thì thu được 2,24 lít khí ở đktc.
Lời giải bài 7 trang 106 sgk hóa 10:
a) Theo bài ra, ta có nAgNO3 = 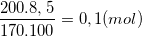
- Phương trình phản ứng:
HCl + AgNO3 → AgCl↓ + HNO3
- Theo PTPƯ thì: nHCl = nAgCl = 0,1 (mol)
⇒ CM (HCl) = n/V = 0,1/0,15 = 0,667 (mol/l).
b) Theo bài ra ta có, nCO2 = V/22,4 = 2,24/22,4 = 0,1 (mol)
- Phương trình phản ứng:
HCl + NaHCO3 → NaCl + CO2↑ + H2O
- Theo PTPƯ: nHCl = nCO2 = 0,1 mol ⇒ mHCl = 0,1. 36,5 = 3,65 g
⇒ C%(HCl) = (mct/mdd).100% = (3,65/50).100% = 7,3%
Hy vọng với bài viết hệ thống lại kiến thức về tính chất hoá học của Axit Clo hidric (HCl), Hiđro clorua và muối Clorua một cách chi tiết ở trên sẽ hữu ích cho các em. Mọi thắc mắc các em hãy để lại bình luận dưới bài viết để được hỗ trợ, nếu thấy bài viết hay thì chia sẻ với bạn bè nhé, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét

















-
 Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa học 10 trang 20 - Kết nối tri thức
Giải Hóa học 10 trang 20 - Kết nối tri thức
-
 Giải Hóa học 10 trang 18 - Kết nối tri thức
Giải Hóa học 10 trang 18 - Kết nối tri thức
-
 Giải Hóa học 10 trang 17 - Kết nối tri thức
Giải Hóa học 10 trang 17 - Kết nối tri thức
-
 Giải Hóa học 10 trang 16 - Kết nối tri thức
Giải Hóa học 10 trang 16 - Kết nối tri thức
-
 Giải Hóa học 10 trang 15 - Kết nối tri thức
Giải Hóa học 10 trang 15 - Kết nối tri thức
-
 Giải Hóa học 10 trang 14 - Kết nối tri thức
Giải Hóa học 10 trang 14 - Kết nối tri thức
-
 Giải Hóa học 10 trang 13 - Kết nối tri thức
Giải Hóa học 10 trang 13 - Kết nối tri thức
-
 Giải Hóa học 10 trang 8 - Kết nối tri thức
Giải Hóa học 10 trang 8 - Kết nối tri thức
-
 Giải Hóa học 10 trang 7 - Kết nối tri thức
Giải Hóa học 10 trang 7 - Kết nối tri thức
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK


















































