Giải bài 2 trang 92 SGK Hoá 10 Chân trời sáng tạo
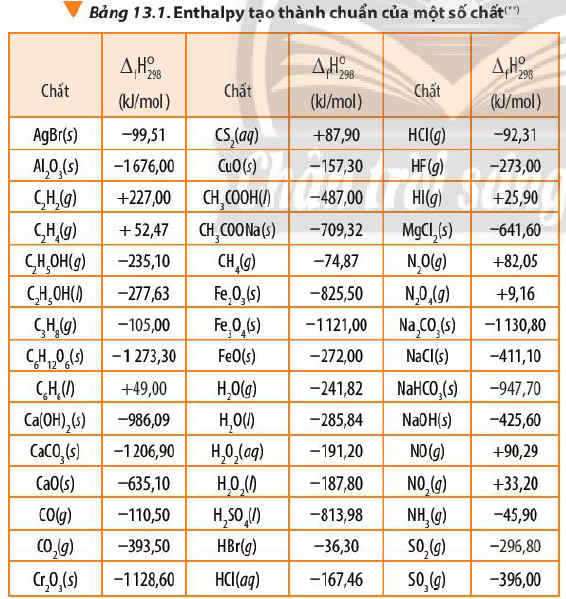
Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene...
Bài 2 trang 92 SGK Hoá 10 (Chân trời sáng tạo): Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l).
So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Giải bài 2 trang 92 SGK Hoá 10 (Chân trời sáng tạo):
- Ta có:
C6H6(l) + O2
6CO2(g) + 3H2O
∆r H0298 = 6.∆f H0298 (CO2) + 3.∆f H0298 (H2O) - ∆f H0298 (C6H6) - ∆f H0298 (O2)
∆r H0298 = 6.(-393,50) + 3.(-285,84) – (+49,00) - .0
∆r H0298 = -3267,52 kJ
1,0 gam C6H6(l) ứng với 1/78 mol C6H6(l)
Đốt cháy 1 mol C6H6(l) tỏa ra 3267,52 kJ nhiệt lượng
⇒ Đốt cháy 1/79 mol C6H6(l) tỏa ra là (1/78).3267,52 = 41,89 kJ nhiệt lượng
C3H8(g) + 5O2 3CO2(g) + 4H2O(g)
∆r H0298 = 3.∆f H0298 (CO2) + 4. ∆f H0298 (H2O) -∆f H0298 (C3H8) – 5.∆f H0298 (O2)
∆r H0298 = 3.(-393,50) + 4.(-285,84) – (-105,00) - 5.0
∆r H0298 = -2218,86 kJ
1,0 gam C3H8(g) ứng với 1/44 mol C3H8(g)
Đốt cháy 1 mol C3H8(g) tỏa ra 2218,86 kJ nhiệt lượng
⇒ Đốt cháy 1/44 mol C3H8(g) tỏa ra là (1/44).2218,86 = 50,43 kJ nhiệt lượng
Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) nhiều hơn khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Hy vọng với lời giải bài 2 trang 92 SGK Hoá 10 (Sách Chân trời Sáng tạo) ở trên đã giúp các em hiểu và nắm vững phần kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Hay Học Hỏi ghi nhận và hỗ trợ, chúc các em học tốt.
• Xem các bài tập Hoá 10 cùng chuyên mục
> Bài 4 trang 93 SGK Hoá 10 (Chân trời sáng tạo): Cho phương trình nhiệt hóa học sau:...
• Xem bài viết Lý thuyết Hoá 10 SGK Chân trời sáng tạo
> Lý thuyết Hoá 10 - Bài 1 SGK Chân trời sáng tạo: Nhập môn hóa học
> Lý thuyết Hoá 10 - Bài 2 SGK Chân trời sáng tạo: Thành phần của nguyên tử
> Lý thuyết Hoá 10 - Bài 3 SGK Chân trời sáng tạo: Nguyên tố hóa học
> Lý thuyết Hoá 10 - Bài 4 SGK Chân trời sáng tạo: Cấu trúc lớp vỏ electron của nguyên tử
> Lý thuyết Hoá 10 - Bài 5 SGK Chân trời sáng tạo: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
> Lý thuyết Hoá 10 - Bài 8 SGK Chân trời sáng tạo: Quy tắc octet
> Lý thuyết Hoá 10 - Bài 9 SGK Chân trời sáng tạo: Liên kết ion
> Lý thuyết Hoá 10 - Bài 10 SGK Chân trời sáng tạo: Liên kết cộng hóa trị
> Lý thuyết Hoá 10 - Bài 11 SGK Chân trời sáng tạo: Liên kết hydrogen và tương tác van der waals
> Lý thuyết Hoá 10 - Bài 14 SGK Chân trời sáng tạo: Tính biến thiên enthalpy của phản ứng hóa học
> Lý thuyết Hoá 10 - Bài 16 SGK Chân trời sáng tạo: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Đánh giá & nhận xét
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 76 Chân trời sáng tạo SGK
Giải Hóa 10 trang 76 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 75 Chân trời sáng tạo SGK
Giải Hóa 10 trang 75 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 74 Chân trời sáng tạo SGK
Giải Hóa 10 trang 74 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 73 Chân trời sáng tạo SGK
Giải Hóa 10 trang 73 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 72 Chân trời sáng tạo SGK
Giải Hóa 10 trang 72 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 71 Chân trời sáng tạo SGK
Giải Hóa 10 trang 71 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 70 Chân trời sáng tạo SGK
Giải Hóa 10 trang 70 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 69 Chân trời sáng tạo SGK
Giải Hóa 10 trang 69 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 68 Chân trời sáng tạo SGK
Giải Hóa 10 trang 68 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 67 Chân trời sáng tạo SGK
Giải Hóa 10 trang 67 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 66 Chân trời sáng tạo SGK
Giải Hóa 10 trang 66 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 65 Chân trời sáng tạo SGK
Giải Hóa 10 trang 65 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 64 Chân trời sáng tạo SGK
Giải Hóa 10 trang 64 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 63 Chân trời sáng tạo SGK
Giải Hóa 10 trang 63 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 62 Chân trời sáng tạo SGK
Giải Hóa 10 trang 62 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 61 Chân trời sáng tạo SGK
Giải Hóa 10 trang 61 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 60 Chân trời sáng tạo SGK
Giải Hóa 10 trang 60 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 59 Chân trời sáng tạo SGK
Giải Hóa 10 trang 59 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 58 Chân trời sáng tạo SGK
Giải Hóa 10 trang 58 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 57 Chân trời sáng tạo SGK
Giải Hóa 10 trang 57 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 56 Chân trời sáng tạo SGK
Giải Hóa 10 trang 56 Chân trời sáng tạo SGK


















































