Phản ứng tỏa nhiệt là gì? Phản ứng thu nhiệt là gì? Tính biến thiên Enthalpy của phản ứng hóa học- Hóa 10 bài 13 CTST
Hầu như mọi phản ứng hóa học cũng như quá trình chuyển thể của chất luôn kèm theo sự thay đổi năng lượng. Ví dụ như Gas cháy sinh nhiệt, phản ứng nhiệt phân gây ra bởi nhiệt năng. Trong cả 2 ví dụ đều có phản ứng xảy ra với sự thay đổi năng lượng...
Vậy phản ứng tỏa nhiệt là gì? Phản ứng thu nhiệt là gì? Tính biến thiên Enthalpy của phản ứng hóa học như thế nào? Ý nghĩa của dấu và giá trị của Enthalpy tạo thành chuẩn là gì?... chúng ta cùng tìm hiểu qua bài viết dưới đây.
1. Phản ứng tỏa nhiệt
- Phản ứng tỏa nhiệt là gì? Phản ứng tỏa nhiệt là phản ứng có sự giải phóng nhiệt năng ra môi trường.
* Ví dụ:
+ Phản ứng nhiệt nhôm tỏa một lượng nhiệt rất lớn làm nóng chảy hỗn hợp chất phản ứng và sắt sinh ra. Ứng dụng để hàn đường ray
2Al + Fe2O3 Al2O3 + 2Fe
+ Phản ứng đốt cháy than tỏa một lượng nhiệt lớn giúp nấu chín thức ăn và sưởi ấm.
C + O2 CO2
2. Phản ứng thu nhiệt
- Phản ứng thu nhiệt là gì? Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
* Ví dụ: Phản ứng nung đá vôi là phản ứng thu nhiệt:
CaCO3(s) CaO(s) + CO2(g)
Nếu ngừng cung cấp nhiệt thì phản ứng sẽ không tiếp tục xảy ra.
3. Biến thiên enthalpy chuẩn của phản ứng
a) Biến thiên enthalpy của phản ứng là gì?
- Biến thiên enthalpy của phản ứng (hay nhiệt phản ứng) được kí hiệu là ∆rH(*), thường tính theo đơn vị kJ hoặc kcal.
- Biến thiên enthalpy của phản ứng là nhiệt lượng tỏa ra hay thu vào của một phản ứng hóa học trong quá trình đẳng áp (áp suất không đổi).
- Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hóa học, được kí hiệu ΔrHo298ΔrH298o, là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn.
- Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/ L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K).
b) Phương trình nhiệt hóa học là gì?
- Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cđ) và sản phẩm (sp).
- Phản ứng thu nhiệt (hệ nhận nhiệt của môi trường) thì ΔrHo298 > 0.
- Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) thì ΔrHo298<0ΔrH298o<0
* Ví dụ:
C(s) + H2O(g) CO(g) + H2(g)
ΔrHo298 = +131,25 kJ >0 (1)
⇒ Phản ứng (1) là phản ứng thu nhiệt.
CuSO4 (aq) + Zn(s) → ZnSO4(aq) + Cu(s)
ΔrHo298 = -231,04 kJ < 0 (2)
⇒ Phản ứng (2) là phản ứng tỏa nhiệt.
4. Enthalpy tạo thành (nhiệt tạo thành)
- Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
- Enthalpy tạo thành (hay nhiệt tạo thành) được kí hiệu bằng ∆fH, thường được tính theo đơn vị kJ/ mol hoặc kcal/mol.
- Enthalpy tạo thành trong điều kiện chuẩn được gọi là enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) và được kí hiệu là ΔfHo298.
* Ví dụ: ΔfHo298.(CO2,g) = -393,50kJ/mol là lượng nhiệt tỏa ra khi tạo ra 1 mol CO2(g) từ các đơn chất ở trạng thái bền ở điều kiện chuẩn (carbon dạng graphite, oxygen dạng phân tử khí chính là các dạng đơn chất bền nhát của carbon và oxygen).
C(graphite) + O2(g) CO2(g)
ΔfHo298(CO2,g) = -393,50kJ/mol
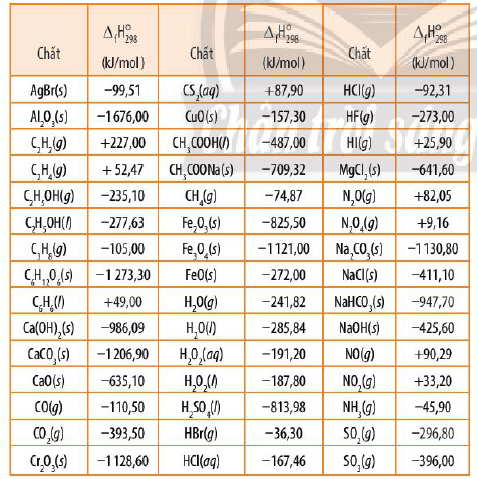 Bảng Enthalpy tạo thành chuẩn của một số chất
Bảng Enthalpy tạo thành chuẩn của một số chất
* Chú ý:
i) ΔfHo298 của đơn chất bền nhất bằng 0 (xét ở điều kiện chuẩn).
ii) ΔfHo298< 0, chất bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó.
iii) ΔfHo298> 0, chất kém bền hơn mặt năng lượng so với các đơn chất bền tạo nên nó.
5. Ý nghĩa của dấu và giá trị ΔrHo298
- Phản ứng tỏa nhiệt:
* Ví dụ:
H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l) ΔrHo298 = -111,68kJ
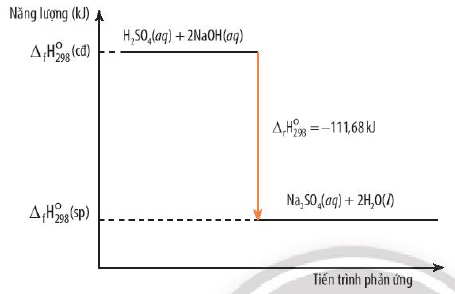 Sơ đồ biểu diễn Enthalpy của phản ứng tỏa nhiệt
Sơ đồ biểu diễn Enthalpy của phản ứng tỏa nhiệt
- Phản ứng thu nhiệt:
* Ví dụ: Phản ứng nhiệt phân CaCO3
CaCO3(s) → CaO(s) + CO2(g) ΔrHo298 = +178,49kJ
- Thường các phản ứng có ΔrHo298< 0 thì xảy ra thuận lợi.
* Chú ý: Phản ứng thu nhiệt cần cung cấp nhiệt liên tục, nếu dừng cung cấp nhiệt phản ứng sẽ không tiếp diễn.
Hy vọng với bài viết Phản ứng tỏa nhiệt là gì? Phản ứng thu nhiệt là gì? Tính biến thiên Enthalpy của phản ứng hóa học Hoá 10 bài 12 sách Chân trời sáng tạo ở trên đã giúp các em hiểu và nắm vững phần kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Hay Học Hỏi ghi nhận và hỗ trợ, chúc các em học tốt.
> Xem Lý thuyết Hóa 10 Chân trời sáng tạo đầy đủ chi tiết
Lý thuyết Hóa 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Lý thuyết Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Lý thuyết Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Lý thuyết Hóa 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Lý thuyết Hóa 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Lý thuyết Hóa 10 Bài 18: Hydrogen halide và một số phản ứng của ion halide
• Xem Giải bài tập SGK Hoá 10 Chân trời sáng tạo
Đánh giá & nhận xét
-
 Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
-
 Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Tính chất vật lí của Hydrogen Halide, tính axit của Hydrohalic, tính khử của các ion Halide - Hoá 10 bài 18 CTST
Tính chất vật lí của Hydrogen Halide, tính axit của Hydrohalic, tính khử của các ion Halide - Hoá 10 bài 18 CTST
-
 Tính chất hoá học tính chất vật lí của Halogen, đặc điểm cấu tạo, trạng thái tự nhiên và ứng dụng của Halogen - Hoá 10 bài 17 CTST
Tính chất hoá học tính chất vật lí của Halogen, đặc điểm cấu tạo, trạng thái tự nhiên và ứng dụng của Halogen - Hoá 10 bài 17 CTST
-
 Các yếu tố ảnh hưởng tới tốc độ phản ứng: Nhiệt độ, nồng độ, áp suất, bề mặt tiếp xúc, chất xúc tác và ví dụ - Hoá 10 bài 16 CTST
Các yếu tố ảnh hưởng tới tốc độ phản ứng: Nhiệt độ, nồng độ, áp suất, bề mặt tiếp xúc, chất xúc tác và ví dụ - Hoá 10 bài 16 CTST
-
 Tốc độ phản ứng hoá học là gì? Công thức biểu thức tính tốc độ phản ứng - Hoá 10 bài 15 CTST
Tốc độ phản ứng hoá học là gì? Công thức biểu thức tính tốc độ phản ứng - Hoá 10 bài 15 CTST
-
 Tính biến thiên Enthalpy của phản ứng dựa vào enthalpy tạo thành và năng lượng liên kết - Hóa 10 bài 14 CTST
Tính biến thiên Enthalpy của phản ứng dựa vào enthalpy tạo thành và năng lượng liên kết - Hóa 10 bài 14 CTST
-
 Phản ứng Oxi hóa Khử là gì? Cách lập phương trình phản ứng Oxi hóa Khử và Ý nghĩa trong cuộc sống - Hóa 10 bài 12 CTST
Phản ứng Oxi hóa Khử là gì? Cách lập phương trình phản ứng Oxi hóa Khử và Ý nghĩa trong cuộc sống - Hóa 10 bài 12 CTST
-
 Liên kết Hydrogen là gì? Tương tác Van Der Waals là gì? Vai trò và ảnh hưởng của liên kết Hydrogen, tương tác Van der waals - Hoá 10 bài 11 CTST
Liên kết Hydrogen là gì? Tương tác Van Der Waals là gì? Vai trò và ảnh hưởng của liên kết Hydrogen, tương tác Van der waals - Hoá 10 bài 11 CTST
-
 Sự hình thành liên kết cộng hoá trị, cách viết công thức Lewis, Liên kết cho nhận và sự hình thành liên kết xích ma, liên kết pi - Hoá 10 bài 10 CTST
Sự hình thành liên kết cộng hoá trị, cách viết công thức Lewis, Liên kết cho nhận và sự hình thành liên kết xích ma, liên kết pi - Hoá 10 bài 10 CTST
-
 Liên kết ion là gì? Sự hình thành liên kết ion? Ion âm, Ion dương là gì? Tinh thể ion là gì? - Hóa 10 bài 9 CTST
Liên kết ion là gì? Sự hình thành liên kết ion? Ion âm, Ion dương là gì? Tinh thể ion là gì? - Hóa 10 bài 9 CTST
-
 Quy tắc OCTET (Bát tử) là gì? Liên kết hóa học là gì, hình thành khi nào? Vận dụng quy tắc OCTET - Hóa 10 bài 8 CTST
Quy tắc OCTET (Bát tử) là gì? Liên kết hóa học là gì, hình thành khi nào? Vận dụng quy tắc OCTET - Hóa 10 bài 8 CTST
-
 Định luật tuần hoàn, Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học - Hoá 10 bài 7 CTST
Định luật tuần hoàn, Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học - Hoá 10 bài 7 CTST
-
 Xu hướng biến đổi bán kính nguyên tử, độ âm điện, tính kim loại, tính phi kim, tính acid base trong chu kỳ và nhóm - Hoá 10 bài 6 CTST
Xu hướng biến đổi bán kính nguyên tử, độ âm điện, tính kim loại, tính phi kim, tính acid base trong chu kỳ và nhóm - Hoá 10 bài 6 CTST
-
 Bảng tuần hoàn các nguyên tố hoá học, phân loại nguyên tố theo cấu hình electron và tính chất hoá học - Hoá 10 bài 5 CTST
Bảng tuần hoàn các nguyên tố hoá học, phân loại nguyên tố theo cấu hình electron và tính chất hoá học - Hoá 10 bài 5 CTST
-
 Hạt nhân nguyên tử, nguyên tố hoá học là gì? Nguyên tử khối là gì? Công thức tính nguyên tử khối trung bình - Hoá 10 bài 3 CTST
Hạt nhân nguyên tử, nguyên tố hoá học là gì? Nguyên tử khối là gì? Công thức tính nguyên tử khối trung bình - Hoá 10 bài 3 CTST
-
 Cấu tạo nguyên tử, hạt nhân nguyên tử, thí nghiệm của Thomson và Rutherford - Hoá 10 bài 2 CTST
Cấu tạo nguyên tử, hạt nhân nguyên tử, thí nghiệm của Thomson và Rutherford - Hoá 10 bài 2 CTST
-
 Đối tượng nghiên cứu của hoá học, vai trò của hoá học trong đời sống sản xuất và phương pháp học - Hoá 10 bài 1 CTST
Đối tượng nghiên cứu của hoá học, vai trò của hoá học trong đời sống sản xuất và phương pháp học - Hoá 10 bài 1 CTST
-
 Mục lục Sách giáo khoa (SGK) Hoá 10 Chân trời sáng tạo - Lý thuyết và bài tập Hóa học 10 CTST
Mục lục Sách giáo khoa (SGK) Hoá 10 Chân trời sáng tạo - Lý thuyết và bài tập Hóa học 10 CTST
-
 Công thức Electron của HClO2, Công thức Lewis và CTCT của HClO2
Công thức Electron của HClO2, Công thức Lewis và CTCT của HClO2
-
 Công thức Electron của HClO, Công thức Lewis và CTCT của HClO
Công thức Electron của HClO, Công thức Lewis và CTCT của HClO
-
 Công thức Electron của H2CO3, Công thức Lewis và CTCT của H2CO3
Công thức Electron của H2CO3, Công thức Lewis và CTCT của H2CO3
-
 Công thức Electron của C2H2, Công thức Lewis và CTCT của C2H2
Công thức Electron của C2H2, Công thức Lewis và CTCT của C2H2
-
 Công thức Electron của CO2, Công thức Lewis và CTCT của CO2
Công thức Electron của CO2, Công thức Lewis và CTCT của CO2
-
 Công thức Electron của BH3, Công thức Lewis và CTCT của BH3
Công thức Electron của BH3, Công thức Lewis và CTCT của BH3
-
 Công thức Electron của SF4, Công thức Lewis và CTCT của SF4
Công thức Electron của SF4, Công thức Lewis và CTCT của SF4
-
 Viết công thức Electron, công thức Lewis và CTCT của nước H2O
Viết công thức Electron, công thức Lewis và CTCT của nước H2O
-
 Viết công thức Electron, công thức Lewis và CTCT của Nitrogen N2
Viết công thức Electron, công thức Lewis và CTCT của Nitrogen N2
-
 Viết công thức Electron, công thức Lewis và CTCT của SF6 (Sulfur hexafluoride)
Viết công thức Electron, công thức Lewis và CTCT của SF6 (Sulfur hexafluoride)


















































