Viết công thức Electron, công thức Lewis và CTCT của SF6 (Sulfur hexafluoride)
Hướng dẫn cách viết công thức Electron, CTCT và công thức Lewis của SF6 (Sulfur hexafluoride) và các nguyên tố hóa học theo chương trình SGK mới cực dễ hiểu.
Bài viết này hướng dẫn cách viết công thức Electron, công thức Lewis và CTCT của SF6 (sulfur hexafluoride) từng bước, cụ thể, dễ hiểu dành cho các em.
1. Viết công thức Electron của SF6
Sự hình thành phân tử SF6:
Nguyên tử F có 7 electron hóa trị, cần thêm 1 electron nữa để đạt octet.Nguyên tử S có 6 electron hóa trị, cần 2 electron để đạt octet.
Trong phân tử SF6, mỗi nguyên tử F góp chung 1 electron với nguyên tử Scạnh nó tạo thành 1 cặp electron dùng chung. Khi đó các nguyên tử Clđã đạt octet.
Công thức electron của SF6 là: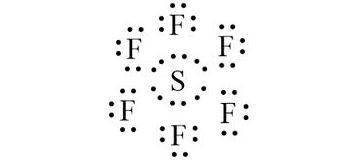
2. Viết công thức Lewis của SF6 (dựa vào công thức electron)
Từ công thức electron, thay mỗi cặp electron dùng chung bằng 1 gạch nối giữa hai nguyên tử ta được công thức Lewis
Từ công thức electron của SF6, thay mỗi cặp electron bằng một gạch nối. Ta được:
Công thức Lewis của SF6 là:
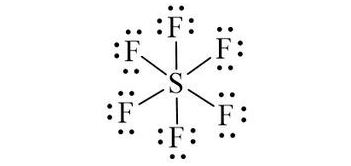
3. Viết công thức Lewis của SF6 (theo công thức phân tử và electron hoá trị)
Ta thực hiện các bước sau:
• Bước 1: Tính tổng số electron hóa trị trong phân tử
S có 6 electron hóa trị, F có 7 electron hóa trị. Trong phân tử SF6, có 1 nguyên tử S và 6 nguyên tử F.
Vậy tổng số electron hóa trị = 6.1 + 7.6 = 48 electron.
• Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
(nguyên tử có độ âm điện nhỏ hơn hay nguyên tử cần nhiều electron hơn để tạo octet là nguyên tử trung tâm)
Trong phân tử SF6, nguyên tử S là nguyên tử trung tâm, các nguyên tử F được xếp xung quanh như sau:
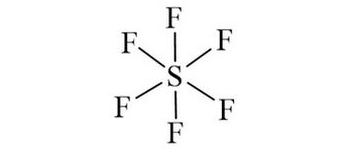
• Bước 3: Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là:
48 – 2.6 = 36 electron.
Sử dụng 36 electron này để tạo octet cho sáu nguyên tử F.
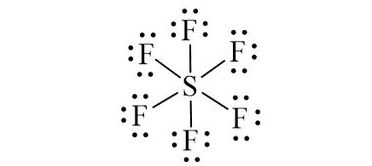
Đã sử dụng hết 36 electron để tạo octet cho 6 nguyên tử F.
Không còn electron hóa trị dư và tất cả các nguyên tử đều đã đạt octet. Nguyên tử S có 12 electron hóa trị thừa octet nhưng điện tích bằng 0 nên công thức trên bền.
Công thức Lewis của SF6 là:

* Lưu ý: Trong một số trường hợp công thức Lewis, nguyên tử trung tâm có thể có số lẻ electron, hoặc nhiều hơn 8 electron, hoặc ít hơn 8 electron.
4. Công thức cấu tạo (CTCT) của SF6 (sulfur hexafluoride)
Từ công thức Lewis, ta loại bỏ đi các electron tự do (electron không tham gia liên kết) thu được công thức cấu tạo.
Công thức cấu tạo của SF6 là: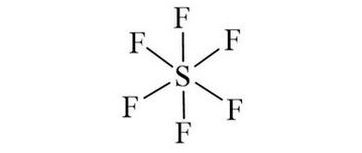
Hy vọng với bài viết về cách viết công thức Electron, công thức Lewis và CTCT của SF6 (Sulfur hexafluoride) ở trên giúp các em hiểu rõ hơn về cấu trúc Lewis. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tốt.
Đánh giá & nhận xét
-
 Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
-
 Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Tính chất vật lí của Hydrogen Halide, tính axit của Hydrohalic, tính khử của các ion Halide - Hoá 10 bài 18 CTST
Tính chất vật lí của Hydrogen Halide, tính axit của Hydrohalic, tính khử của các ion Halide - Hoá 10 bài 18 CTST
-
 Tính chất hoá học tính chất vật lí của Halogen, đặc điểm cấu tạo, trạng thái tự nhiên và ứng dụng của Halogen - Hoá 10 bài 17 CTST
Tính chất hoá học tính chất vật lí của Halogen, đặc điểm cấu tạo, trạng thái tự nhiên và ứng dụng của Halogen - Hoá 10 bài 17 CTST
-
 Các yếu tố ảnh hưởng tới tốc độ phản ứng: Nhiệt độ, nồng độ, áp suất, bề mặt tiếp xúc, chất xúc tác và ví dụ - Hoá 10 bài 16 CTST
Các yếu tố ảnh hưởng tới tốc độ phản ứng: Nhiệt độ, nồng độ, áp suất, bề mặt tiếp xúc, chất xúc tác và ví dụ - Hoá 10 bài 16 CTST
-
 Tốc độ phản ứng hoá học là gì? Công thức biểu thức tính tốc độ phản ứng - Hoá 10 bài 15 CTST
Tốc độ phản ứng hoá học là gì? Công thức biểu thức tính tốc độ phản ứng - Hoá 10 bài 15 CTST
-
 Tính biến thiên Enthalpy của phản ứng dựa vào enthalpy tạo thành và năng lượng liên kết - Hóa 10 bài 14 CTST
Tính biến thiên Enthalpy của phản ứng dựa vào enthalpy tạo thành và năng lượng liên kết - Hóa 10 bài 14 CTST
-
 Phản ứng tỏa nhiệt là gì? Phản ứng thu nhiệt là gì? Tính biến thiên Enthalpy của phản ứng hóa học- Hóa 10 bài 13 CTST
Phản ứng tỏa nhiệt là gì? Phản ứng thu nhiệt là gì? Tính biến thiên Enthalpy của phản ứng hóa học- Hóa 10 bài 13 CTST
-
 Phản ứng Oxi hóa Khử là gì? Cách lập phương trình phản ứng Oxi hóa Khử và Ý nghĩa trong cuộc sống - Hóa 10 bài 12 CTST
Phản ứng Oxi hóa Khử là gì? Cách lập phương trình phản ứng Oxi hóa Khử và Ý nghĩa trong cuộc sống - Hóa 10 bài 12 CTST
-
 Liên kết Hydrogen là gì? Tương tác Van Der Waals là gì? Vai trò và ảnh hưởng của liên kết Hydrogen, tương tác Van der waals - Hoá 10 bài 11 CTST
Liên kết Hydrogen là gì? Tương tác Van Der Waals là gì? Vai trò và ảnh hưởng của liên kết Hydrogen, tương tác Van der waals - Hoá 10 bài 11 CTST
-
 Sự hình thành liên kết cộng hoá trị, cách viết công thức Lewis, Liên kết cho nhận và sự hình thành liên kết xích ma, liên kết pi - Hoá 10 bài 10 CTST
Sự hình thành liên kết cộng hoá trị, cách viết công thức Lewis, Liên kết cho nhận và sự hình thành liên kết xích ma, liên kết pi - Hoá 10 bài 10 CTST
-
 Liên kết ion là gì? Sự hình thành liên kết ion? Ion âm, Ion dương là gì? Tinh thể ion là gì? - Hóa 10 bài 9 CTST
Liên kết ion là gì? Sự hình thành liên kết ion? Ion âm, Ion dương là gì? Tinh thể ion là gì? - Hóa 10 bài 9 CTST
-
 Quy tắc OCTET (Bát tử) là gì? Liên kết hóa học là gì, hình thành khi nào? Vận dụng quy tắc OCTET - Hóa 10 bài 8 CTST
Quy tắc OCTET (Bát tử) là gì? Liên kết hóa học là gì, hình thành khi nào? Vận dụng quy tắc OCTET - Hóa 10 bài 8 CTST
-
 Định luật tuần hoàn, Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học - Hoá 10 bài 7 CTST
Định luật tuần hoàn, Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học - Hoá 10 bài 7 CTST
-
 Xu hướng biến đổi bán kính nguyên tử, độ âm điện, tính kim loại, tính phi kim, tính acid base trong chu kỳ và nhóm - Hoá 10 bài 6 CTST
Xu hướng biến đổi bán kính nguyên tử, độ âm điện, tính kim loại, tính phi kim, tính acid base trong chu kỳ và nhóm - Hoá 10 bài 6 CTST
-
 Bảng tuần hoàn các nguyên tố hoá học, phân loại nguyên tố theo cấu hình electron và tính chất hoá học - Hoá 10 bài 5 CTST
Bảng tuần hoàn các nguyên tố hoá học, phân loại nguyên tố theo cấu hình electron và tính chất hoá học - Hoá 10 bài 5 CTST
-
 Hạt nhân nguyên tử, nguyên tố hoá học là gì? Nguyên tử khối là gì? Công thức tính nguyên tử khối trung bình - Hoá 10 bài 3 CTST
Hạt nhân nguyên tử, nguyên tố hoá học là gì? Nguyên tử khối là gì? Công thức tính nguyên tử khối trung bình - Hoá 10 bài 3 CTST
-
 Cấu tạo nguyên tử, hạt nhân nguyên tử, thí nghiệm của Thomson và Rutherford - Hoá 10 bài 2 CTST
Cấu tạo nguyên tử, hạt nhân nguyên tử, thí nghiệm của Thomson và Rutherford - Hoá 10 bài 2 CTST
-
 Đối tượng nghiên cứu của hoá học, vai trò của hoá học trong đời sống sản xuất và phương pháp học - Hoá 10 bài 1 CTST
Đối tượng nghiên cứu của hoá học, vai trò của hoá học trong đời sống sản xuất và phương pháp học - Hoá 10 bài 1 CTST
-
 Mục lục Sách giáo khoa (SGK) Hoá 10 Chân trời sáng tạo - Lý thuyết và bài tập Hóa học 10 CTST
Mục lục Sách giáo khoa (SGK) Hoá 10 Chân trời sáng tạo - Lý thuyết và bài tập Hóa học 10 CTST
-
 Công thức Electron của HClO2, Công thức Lewis và CTCT của HClO2
Công thức Electron của HClO2, Công thức Lewis và CTCT của HClO2
-
 Công thức Electron của HClO, Công thức Lewis và CTCT của HClO
Công thức Electron của HClO, Công thức Lewis và CTCT của HClO
-
 Công thức Electron của H2CO3, Công thức Lewis và CTCT của H2CO3
Công thức Electron của H2CO3, Công thức Lewis và CTCT của H2CO3
-
 Công thức Electron của C2H2, Công thức Lewis và CTCT của C2H2
Công thức Electron của C2H2, Công thức Lewis và CTCT của C2H2
-
 Công thức Electron của CO2, Công thức Lewis và CTCT của CO2
Công thức Electron của CO2, Công thức Lewis và CTCT của CO2
-
 Công thức Electron của BH3, Công thức Lewis và CTCT của BH3
Công thức Electron của BH3, Công thức Lewis và CTCT của BH3
-
 Công thức Electron của SF4, Công thức Lewis và CTCT của SF4
Công thức Electron của SF4, Công thức Lewis và CTCT của SF4
-
 Viết công thức Electron, công thức Lewis và CTCT của nước H2O
Viết công thức Electron, công thức Lewis và CTCT của nước H2O
-
 Viết công thức Electron, công thức Lewis và CTCT của Nitrogen N2
Viết công thức Electron, công thức Lewis và CTCT của Nitrogen N2


















































