Tính chất vật lí của Hydrogen Halide, tính axit của Hydrohalic, tính khử của các ion Halide - Hoá 10 bài 18 CTST
Thuỷ tinh vốn cứng, trơn và khá trơ về mặt hoá học nên việc chạm khắc là điều không đơn giản. Muốn khắc các hoa văn, cần phủ lên bề mặt thuỷ tinh một lớp paraffin, thực hiện chạm khắc các hoa văn lên lớp paraffin, để phần thuỷ tinh cần khắc lộ ra. Nhỏ dung dịch hydrofluoric acid hoặc hỗn hợp CaF2 và H2SO4 đặc lên lớp paraffin đó, phần thuỷ tinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoa văn trên vật dụng cần trang trí.
Vậy quá trình ăn mòn thuỷ tinh xảy ra như thế nào? tính chất vật lí của hydrogen halide là gì? các ion halide có tính chất gì và nhận biết ion halide như thế nào? tính acid của hydrohalic thể hiện ra sao?... chúng ta cùng tìm hiểu qua bài viết dưới đây.
1. Tính chất vật lí của hydrogen halide
- Hydrogen halide là hợp chất của hydrogen với halogen, công thức tổng quát là HX, với X là halogen. Hậu tố "ide" trong hydrogen halide được thay thế từ hậu tố "ine" của tên halogen.
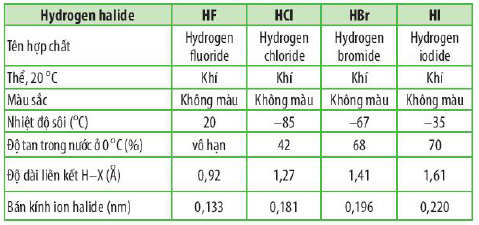 Bảng mô tả đặc điểm tích chất của các hydrogen halide HX
Bảng mô tả đặc điểm tích chất của các hydrogen halide HX
+ Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI.
Giải thích: Khối lượng phân tử tăng làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử dẫn đến tương tác van der Waals giữa các phân tử tăng.
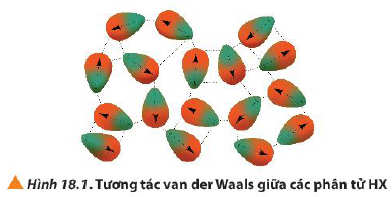
+ Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen flouride cao bất thường so với các hydrogen halide còn lại.
+ Nhờ liên kết hydrogen giữa các phân tử nên hydrogen fluoride khó bay hơi hơn các hydrogen halide còn lại.
2. Hydrohalic acid
- Các hydrogen halide tan trong nước, tạo thành hydrohalic acid tương ứng.
- Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid.
- Hydrofluoric acid (HF) là acid rất yếu, nhưng có tính chất đặc biệt là ăn mòn thủy tinh, phương trình hóa học của phản ứng:
SiO2 + 4HF → SiF4↑ + 2H2O
- Các dung dịch HCl, HBr, HI là những acid mạnh, có đầy đủ tính chất hóa học chung của acid như: làm quỳ tím chuyển sang màu đỏ, tác dụng với kim loại đứng trước hydrogen trong dãy hoạt động hóa học, tác dụng với basic oxide, base và một số muối.
* Ví dụ:
NaOH + HCl → NaCl + H2O
Zn + 2HCl → ZnCl2 + H2
CaO + 2HBr → CaBr2 + H2O
K2CO3 + 2HI → 2KI + H2O + CO2
3. Tính khử của các ion halide
- Trong ion halide, các halogen có số oxi hóa thấp nhất là -1, do đó ion halide chỉ thể hiện tính khử trong phản ứng oxi hóa – khử.
- Tính khử của các ion halide tăng theo chiều: F- < Cl- < Br- < I-
* Ví dụ: Khi đun nóng các muối khan halide với H2SO4 đặc:
+ Ion chloride không khử được H2SO4 nên chỉ xảy ra phản ứng trao đổi.
KCl + H2SO4 (đặc) → KHSO4 + HCl↑
+ Ion bromide khử H2SO4 đặc thành SO2 và Br- bị oxi hóa thành Br2, sản phẩm có màu vàng đậm.
2KBr + 2H2SO4 (đặc) → Br2 + SO2↑ + K2SO4 + 2H2O
+ Ion iodide có thể khử H2SO4 đặc thành H2S, S, SO2 tùy vào điều kiện phản ứng và I- bị oxi hóa thành I2 có màu đen tím.
2KI + 2H2SO4 (đặc) → I2↓ + SO2↑ + K2SO4 + 2H2O
6KI + 4H2SO4 (đặc) → 3I2↓ + S↓ + 3K2SO4 + 4H2O
8KI + 5H2SO4 (đặc) → 4I2 + H2S↑ + 4K2SO4 + 4H2O

4. Nhận biết ion halide trong dung dịch
- Phân biệt các ion F-, Cl-, Br- và I- bằng cách cho dung dịch silver nitrate (AgNO3) vào dung dịch muối của chúng.
- Phương trình hóa học minh họa:
NaF + AgNO3 → không phản ứng
NaCl + AgNO3 → AgCl↓ + NaNO3
NaBr + AgNO3 → AgBr↓ + NaNO3
NaI + AgNO3 → AgI↓ + NaNO3
5. Ứng dụng của các hydrogen halide
- Hydrogen fluoride: Dùng để tẩy cặn trong các thiết bị trao đổi nhiệt; chất xúc tác trong các nhà máy lọc dầu, công nghệ làm giàu uranium, sản xuất dược phẩm, …
- Hydrogen chloride: Dùng để loại bỏ gỉ thép, sản xuất chất tẩy rửa nhà vệ sinh, các hợp chất vô cơ và hữu cơ phục vụ đời sống và sản xuất,…
- Hydrogen bromide: Làm chất xúc tác cho các phản ứng hữu cơ, tổng hợp chất chống cháy chứa nguyên tố bromine như tetrabromobisphenol A, điều chế nhựa epoxy, sản xuất các vi mạch điện tử.
- Hydrogen iodide: Dùng làm chất khử phổ biến trong các phản ứng hóa học; sản xuất iodine và ankyl iodide…
Hy vọng với bài viết Tính chất vật lí của Hydrogen Halide, tính axit của Hydrohalic, tính khử của các ion Halide và cách nhận biết ion halide - Hoá 10 bài 18 sách Chân trời sáng tạo ở trên đã giúp các em hiểu và nắm vững phần kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Hay Học Hỏi ghi nhận và hỗ trợ, chúc các em học tốt.
> Xem Lý thuyết Hóa 10 Chân trời sáng tạo đầy đủ chi tiết
Lý thuyết Hóa 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Lý thuyết Hóa 10 Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Lý thuyết Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Lý thuyết Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Lý thuyết Hóa 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Lý thuyết Hóa 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
• Xem Giải bài tập SGK Hoá 10 Chân trời sáng tạo
Đánh giá & nhận xét
-
 Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
-
 Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Tính chất hoá học tính chất vật lí của Halogen, đặc điểm cấu tạo, trạng thái tự nhiên và ứng dụng của Halogen - Hoá 10 bài 17 CTST
Tính chất hoá học tính chất vật lí của Halogen, đặc điểm cấu tạo, trạng thái tự nhiên và ứng dụng của Halogen - Hoá 10 bài 17 CTST
-
 Các yếu tố ảnh hưởng tới tốc độ phản ứng: Nhiệt độ, nồng độ, áp suất, bề mặt tiếp xúc, chất xúc tác và ví dụ - Hoá 10 bài 16 CTST
Các yếu tố ảnh hưởng tới tốc độ phản ứng: Nhiệt độ, nồng độ, áp suất, bề mặt tiếp xúc, chất xúc tác và ví dụ - Hoá 10 bài 16 CTST
-
 Tốc độ phản ứng hoá học là gì? Công thức biểu thức tính tốc độ phản ứng - Hoá 10 bài 15 CTST
Tốc độ phản ứng hoá học là gì? Công thức biểu thức tính tốc độ phản ứng - Hoá 10 bài 15 CTST
-
 Tính biến thiên Enthalpy của phản ứng dựa vào enthalpy tạo thành và năng lượng liên kết - Hóa 10 bài 14 CTST
Tính biến thiên Enthalpy của phản ứng dựa vào enthalpy tạo thành và năng lượng liên kết - Hóa 10 bài 14 CTST
-
 Phản ứng tỏa nhiệt là gì? Phản ứng thu nhiệt là gì? Tính biến thiên Enthalpy của phản ứng hóa học- Hóa 10 bài 13 CTST
Phản ứng tỏa nhiệt là gì? Phản ứng thu nhiệt là gì? Tính biến thiên Enthalpy của phản ứng hóa học- Hóa 10 bài 13 CTST
-
 Phản ứng Oxi hóa Khử là gì? Cách lập phương trình phản ứng Oxi hóa Khử và Ý nghĩa trong cuộc sống - Hóa 10 bài 12 CTST
Phản ứng Oxi hóa Khử là gì? Cách lập phương trình phản ứng Oxi hóa Khử và Ý nghĩa trong cuộc sống - Hóa 10 bài 12 CTST
-
 Liên kết Hydrogen là gì? Tương tác Van Der Waals là gì? Vai trò và ảnh hưởng của liên kết Hydrogen, tương tác Van der waals - Hoá 10 bài 11 CTST
Liên kết Hydrogen là gì? Tương tác Van Der Waals là gì? Vai trò và ảnh hưởng của liên kết Hydrogen, tương tác Van der waals - Hoá 10 bài 11 CTST
-
 Sự hình thành liên kết cộng hoá trị, cách viết công thức Lewis, Liên kết cho nhận và sự hình thành liên kết xích ma, liên kết pi - Hoá 10 bài 10 CTST
Sự hình thành liên kết cộng hoá trị, cách viết công thức Lewis, Liên kết cho nhận và sự hình thành liên kết xích ma, liên kết pi - Hoá 10 bài 10 CTST
-
 Liên kết ion là gì? Sự hình thành liên kết ion? Ion âm, Ion dương là gì? Tinh thể ion là gì? - Hóa 10 bài 9 CTST
Liên kết ion là gì? Sự hình thành liên kết ion? Ion âm, Ion dương là gì? Tinh thể ion là gì? - Hóa 10 bài 9 CTST
-
 Quy tắc OCTET (Bát tử) là gì? Liên kết hóa học là gì, hình thành khi nào? Vận dụng quy tắc OCTET - Hóa 10 bài 8 CTST
Quy tắc OCTET (Bát tử) là gì? Liên kết hóa học là gì, hình thành khi nào? Vận dụng quy tắc OCTET - Hóa 10 bài 8 CTST
-
 Định luật tuần hoàn, Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học - Hoá 10 bài 7 CTST
Định luật tuần hoàn, Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học - Hoá 10 bài 7 CTST
-
 Xu hướng biến đổi bán kính nguyên tử, độ âm điện, tính kim loại, tính phi kim, tính acid base trong chu kỳ và nhóm - Hoá 10 bài 6 CTST
Xu hướng biến đổi bán kính nguyên tử, độ âm điện, tính kim loại, tính phi kim, tính acid base trong chu kỳ và nhóm - Hoá 10 bài 6 CTST
-
 Bảng tuần hoàn các nguyên tố hoá học, phân loại nguyên tố theo cấu hình electron và tính chất hoá học - Hoá 10 bài 5 CTST
Bảng tuần hoàn các nguyên tố hoá học, phân loại nguyên tố theo cấu hình electron và tính chất hoá học - Hoá 10 bài 5 CTST
-
 Hạt nhân nguyên tử, nguyên tố hoá học là gì? Nguyên tử khối là gì? Công thức tính nguyên tử khối trung bình - Hoá 10 bài 3 CTST
Hạt nhân nguyên tử, nguyên tố hoá học là gì? Nguyên tử khối là gì? Công thức tính nguyên tử khối trung bình - Hoá 10 bài 3 CTST
-
 Cấu tạo nguyên tử, hạt nhân nguyên tử, thí nghiệm của Thomson và Rutherford - Hoá 10 bài 2 CTST
Cấu tạo nguyên tử, hạt nhân nguyên tử, thí nghiệm của Thomson và Rutherford - Hoá 10 bài 2 CTST
-
 Đối tượng nghiên cứu của hoá học, vai trò của hoá học trong đời sống sản xuất và phương pháp học - Hoá 10 bài 1 CTST
Đối tượng nghiên cứu của hoá học, vai trò của hoá học trong đời sống sản xuất và phương pháp học - Hoá 10 bài 1 CTST
-
 Mục lục Sách giáo khoa (SGK) Hoá 10 Chân trời sáng tạo - Lý thuyết và bài tập Hóa học 10 CTST
Mục lục Sách giáo khoa (SGK) Hoá 10 Chân trời sáng tạo - Lý thuyết và bài tập Hóa học 10 CTST
-
 Công thức Electron của HClO2, Công thức Lewis và CTCT của HClO2
Công thức Electron của HClO2, Công thức Lewis và CTCT của HClO2
-
 Công thức Electron của HClO, Công thức Lewis và CTCT của HClO
Công thức Electron của HClO, Công thức Lewis và CTCT của HClO
-
 Công thức Electron của H2CO3, Công thức Lewis và CTCT của H2CO3
Công thức Electron của H2CO3, Công thức Lewis và CTCT của H2CO3
-
 Công thức Electron của C2H2, Công thức Lewis và CTCT của C2H2
Công thức Electron của C2H2, Công thức Lewis và CTCT của C2H2
-
 Công thức Electron của CO2, Công thức Lewis và CTCT của CO2
Công thức Electron của CO2, Công thức Lewis và CTCT của CO2
-
 Công thức Electron của BH3, Công thức Lewis và CTCT của BH3
Công thức Electron của BH3, Công thức Lewis và CTCT của BH3
-
 Công thức Electron của SF4, Công thức Lewis và CTCT của SF4
Công thức Electron của SF4, Công thức Lewis và CTCT của SF4
-
 Viết công thức Electron, công thức Lewis và CTCT của nước H2O
Viết công thức Electron, công thức Lewis và CTCT của nước H2O
-
 Viết công thức Electron, công thức Lewis và CTCT của Nitrogen N2
Viết công thức Electron, công thức Lewis và CTCT của Nitrogen N2
-
 Viết công thức Electron, công thức Lewis và CTCT của SF6 (Sulfur hexafluoride)
Viết công thức Electron, công thức Lewis và CTCT của SF6 (Sulfur hexafluoride)


















































