Luyện tập tính chất hóa học của nhóm halogen, hợp chất halogen và bài tập - hóa 10 bài 26
Nhóm halogen gồm các nguyên tố flo (F), clo (Cl), brom (Br), iot (I) và atatin (At). Atatin không gặp trong tự nhiên mà được điều chế trong các lò phản ứng hạt nhân nên được xem như nguyên tố phóng xạ.
Ở bài học trước, chúng ta đã được học về tính chất hóa học của các nguyên tố trong nhóm halogen này như flo (F), clo (Cl), brom (Br), iot (I). Trong phần này chúng ta sẽ ôn tập và hệ thống lại kiến thức về tính chất hóa học của các nghuyên tố Halogen và làm một số bài tập vận dụng.
I. Vị trí của nhóm Halogen trong bảng HTTH
- Nhóm halogen: nhóm VIIA.
- Nhóm halogen: gồm Flo (F), Clo (Cl), Brom (Br) và Iot (I).
II. Cấu tạo nguyên tử và phân tử của của các Halogen
- Lớp electron ngoài cùng của nguyên tử các nguyên tố halogen đều có 7 electron, được phân thành 2 phân lớp : phân lớp s có 2 electron, phân lớp p có 5 electron (ns2np5).
- Vì có 7 electron ở lớp ngoài cùng, chỉ còn thiếu 1 electron là đạt được cấu hình electron bền như khí hiếm, nên ở trạng thái tự do, hai nguyên tử halogen góp chung một đôi electron để tạo ra phân tử có liên kết cộng hoá trị không cực.
- Liên kết của phân tử X2 không bền lắm, chúng dễ bị tách thành 2 nguyên tử X. Trong phản ứng hoá học, các nguyên tử này hoạt động mạnh vì chúng dễ thu thêm 1 electron, do đó tính chất hoá học cơ bản của các halogen là tính oxi hoá mạnh.
III. Tính chất vật lý của nhóm Halogen
- Trạng thái và màu sắc: Flo (khí, lục nhạt), Clo (khí, vàng lục), Brom (lỏng, đỏ nâu) và Iot (rắn, đen tím, dễ thăng hoa).
- Từ flo đến iot, nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
- Các halogen (Clo, Brom, Iot) khác tan tương đối ít trong nước và tan nhiều trong một số dung môi hữu cơ.
IV. Tính chất hóa học chung của Halogen
- Do lớp e ngoài cùng đã có 7e nên halogen là những phi kim điển hình, dễ nhận thêm 1e thể hiện tính oxi hóa mạnh.
- Tính oxi hóa của các halogen giảm dần khi đi từ F2 đến I2.
- Trong các hợp chất, F chỉ có mức oxi hóa -1; các halogen khác ngoài mức oxi hóa -1 còn có mức +1; +3; +5; +7.
1. Halogen tác dụng với kim loại
- Các halogen phản ứng với hầu hết các kim loại trừ Au và Pt (riêng F2 phản ứng được với tất cả các kim loại) → muối halogenua. Các phản ứng thường xảy ra ở nhiệt độ cao.
2M + nX2 → 2MXn
Muối thu được thường ứng với mức hóa trị cao nhất của kim loại. Riêng phản ứng của Fe với I2 chỉ tạo sản phẩm là FeI2.
2. Halogen phản ứng với hiđro tạo thành hiđro halogenua
H2 + X2 → 2HX
- Các halogen tham gia phản ứng cộng H2 với điều kiện khác nhau:
+ F2: phản ứng được ngay cả trong bóng tối.
+ Cl2: phản ứng khi được chiếu sáng.
+ Br2: phản ứng xảy ra khi được đun nóng ở nhiệt độ cao.
+ I2: phản ứng có tính thuận nghịch và phải được đun nóng.
- Điều kiện phản ứng với H2 phức tạp dần khi đi từ F2 đến I2 nên phản ứng với H2 có thể chứng minh tính oxi hóa trong nhóm halogen giảm dần từ F2 đến I2.
3. Halogen tác dụng với nước
- F2 tác dụng mãnh liệt với nước:
2H2O + 2F2 → 4HF + O2
⇒ Phản ứng chứng minh F2 có tính oxi hóa mạnh hơn của O2.
- Br2 và Cl2 có phản ứng thuận nghịch với nước:
H2O + X2 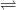 HX + HXO (axit halogen hiđric và axit hipohalogenơ)
HX + HXO (axit halogen hiđric và axit hipohalogenơ)
H2O + Cl2 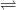 HCl + HClO
HCl + HClO
- Khi để lâu hoặc bị chiếu sáng thì HClO bị phân hủy: HClO → HCl + O. Vì HClO có chứa ion ClO- có tính oxi hóa mạnh nên có thể dùng nước Clo để tẩy màu hoặc sát trùng.
- I2 không phản ứng với nước.
4. Halogen phản ứng với dung dịch kiềm
- Nếu dung dịch kiềm loãng nguội:
X2 + 2NaOH → NaX + NaXO + H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
→ (nước Javen)
2Cl2 + 2Ca(OH)2 dung dịch → CaCl2 + Ca(ClO)2 + 2H2O
Cl2 + Ca(OH)2 bột → CaOCl2 + H2O
→ (clorua vôi)
Riêng F2:
2F2 + 2NaOH → 2NaF + H2O + OF2
- Nếu dung dịch kiềm đặc nóng:
3X2 + 6KOH → 5KX + KXO3 + 3H2O
3Cl2 + 6KOH ![small xrightarrow[]{100^{0}C}](https://hayhochoi.vn/uploads/news/wyswyg/2020_09/1600393243umn6k98zz7.gif) 5KCl + KClO3 + 3H2O
5KCl + KClO3 + 3H2O
5. Halogen tác dụng với dung dịch muối halogenua của halogen có tính oxi hóa yếu hơn
- Phản ứng dưới đây X' là halogen có tính oxi hóa yếu hơn tính oxi hóa của halogen X.
X2 + 2NaX’ → 2NaX + X’2
- Riêng F2 không có phản ứng trên
- Các cặp oxi hóa - khử của halogen được xếp theo chiều giảm dần tính khử của các ion X-: I2/2I- > Br2/2Br- > Cl2/2Cl-
- Trong nước:
5Cl2 + 6H2O + Br2 → 10HCl + 2HBrO3
6. Một số phản ứng khác của Halogen
2FeCl2 + Cl2 → 2FeCl3
3Cl2 + 2NH3 → N2 + 6HCl
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
Br2 + SO2 + 2H2O → 2HBr + H2SO4
I2 kết hợp với hồ tinh bột → hợp chất màu xanh tím.
* Chú ý: Trong phản ứng với kim loại và với H2, với dung dung dịch muối của các halogen yếu hơn, halogen là chất oxi hóa. Còn trong phản ứng với nước và dung dịch kiềm, các halogen vừa là chất khử, vừa là chất oxi hóa.
IV. Điều chế Halogen
1. Điện phân muối halogenua
- Điện phân nóng chảy:
2MXn → 2M + nX2 (M là kim loại kiềm: Na, K; X thường là: Cl, Br, I).
- Điện phân dung dịch muối halogenua của kim loại kiềm có màng ngăn:
2NaCl + 2H2O → H2 + 2NaOH + Cl2
2. Cho HX tác dụng với các chất oxi hóa mạnh
- Thường gặp: MnO2, KMnO4, K2Cr2O7, KClO3.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
KClO3 + 6HCl → 3H2O + KCl + 3Cl2
V. Ứng dụng của Halogen
1. Ứng dụng của clo
- Dùng làm chất sát trùng trong hệ thống cung cấp nước sạch, khi xử lí nước thải.
- Tẩu trắng vải, sợi, giấy.
- Là nguyên liệu để sản xuất nhiều hợp chất hữu cơ và vô cơ.
2. Ứng dụng của flo
- Làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa.
- Dùng trong công nghiệp sản xuất nhiên liệu hạt nhân để làm giàu 235U.
- Ứng dụng quan trọng của flo là ở dạng dẫn xuất:
+ Dẫn xuất halogen của flo có nhiều ứng dụng: teflon (-CF2-CF2-)n là chất dẻo chịu được axit, kiềm và nhiều hóa chất khác; Freon (chủ yếu là CFCl3 và CF2Cl2) đường dùng trong các tủ lạnh và máy lạnh...
+ NaF được dùng làm thuốc chống sâu răng.
3. Ứng dụng của brom
- Chế tạo dược phẩm, phẩm nhuộm...
- Dùng để chế tạo AgBr là chất nhạy cảm với ánh sáng để tráng lên phim ảnh.
4. Ứng dụng của iot
- Dùng chủ yếu ở dạng cồn iot làm chất sát trùng.
- Có trong thành phần của nhiêu dược phẩm.
- Trộn KI và KIO3 vào muối ăn tạo ra muối iot.
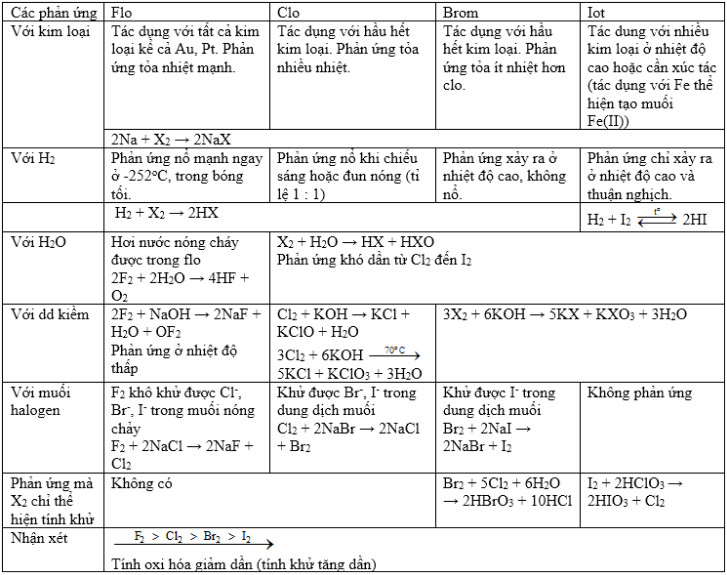
* Bảng tóm tắt tính chất hóa học của Flo, Brom, Iot, Clo
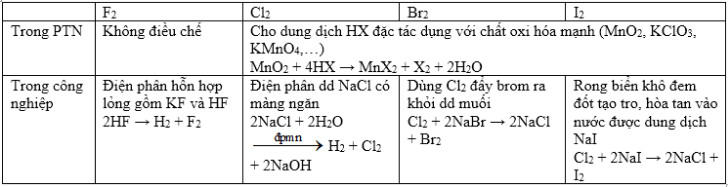
* Phương pháp điều chế Flo, Brom, Iot và Clo
VI - Phân Biệt Các Ion F-, Cl-, Br-, I-
|
|
NaF |
NaCl |
NaBr |
NaI |
|
AgNO3 |
Không PƯ |
AgCl↓ trắng |
AgBr↓ vàng nhạt |
AgI↓ vàng |
VII. Bài tập về nhóm Halogen
* Bài 1 trang 118 SGK Hóa 10: Dãy aixt nào sau đây được sắp xếp đúng theo thứu tự tính axit giảm dần:
A. HCl, HBr, HI, HF.
B. HBr, HI, HF, HCl.
C. HI, HBr, HCl, HF.
D. HF, HCl, HBr, HI.
* Bài 2 trang 118 SGK Hóa 10: Đổ dung dịch AgNO3 vào dung dịch muối nào sau đây sẽ không có phản ứng:
A. NaF. B. NaCl. C. NaBr. D. NaI.
° Lời giải bài 2 trang 118 SGK Hóa 10:
- Đáp án: A. NaF không phản ứng.
* Bài 3 trang 118 SGK Hóa 10: Brom đóng vai trò gì trong phản ứng sau:
SO2 + Br2+ 2H2O → H2SO4 + 2HBr.
A. Chất khử.
B. Chất oxi hóa.
C. Vừa là chất oxi hóa, vừa là chất khử.
D. Không là chất oxi hóa, không là chất khử.
Chọn đáp án đúng.
° Lời giải bài 3 trang 118 SGK Hóa 10:
- Đáp án: B : Br là chất oxi hóa (do nhận electron)
* Bài 4 trang 118 SGK Hóa 10: Chọn câu đúng khi nói về flo, clo, brom, iot:
A. Flo có tính oxi hóa rất mạnh, oxi hóa mãnh liệt nước.
B. Clo có tính oxi hóa mạnh, oxi hóa được nước.
C. Brom có tính oxi hóa mạnh, nhưng yếu hơn flo và clo, nó cũng oxi hóa được nước.
D. Iot có tính oxi hóa yếu hơn flo, clo, brom nhưng cũng oxi hóa được nước.
° Lời giải bài 4 trang 118 SGK Hóa 10:
- Đáp án: A đúng. Flo có tính oxi hóa rất mạnh, oxi hóa mãnh liệt nước.
* Bài 6 trang 119 SGK Hóa 10: Có những chất sau: KMnO4, MnO2, K2Cr2O7 và dung dịch HCl.
a) Nếu các chất oxi hóa có khối lượng bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
b) Nếu chất oxi hóa có số mol bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
Hãy trả lời bằng cách tính toán trên cơ sở của các phương trình phản ứng.
° Lời giải bài 6 trang 119 SGK Hóa 10:
a) Giả sử lấy lượng mỗi chất là a gam
- Các phương trình hóa học của phản ứng
MnO2 + 4HCl → MnCl2 + Cl2↑ + H2O (1)
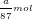
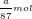
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O (2)
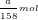
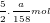
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O (3)
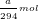
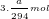
- Theo PTPƯ (1): nCl2 = nMnO2 = a/87 (mol)
- Theo PTPƯ (2): nCl2 = (5/2).nKMnO4 = (5/2).(a/158) = a/63,2 (mol)
- Theo PTPƯ (3): nCl2 = 3.nK2Cr2O7 = 3.(a/294) = a/98 (mol)
⇒ Ta có: a/63,2 > a/87 > a/98
⇒ Lượng Cl2 điều chế được từ PTPƯ (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
- Theo PTPƯ (1) nCl2 = nMnO2 = a (mol)
- Theo PTPƯ (2) nCl2 = (5/2).nKMnO4 = 2,5a (mol)
- Theo PTPƯ (3) nCl2 = 3.nK2Cr2O7 = 3a (mol)
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ PTPƯ (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.
* Bài 7 trang 119 SGK Hóa 10: Tính khối lượng HCl bị oxi hóa bởi MnO2, biết rằng khí Cl2 sinh ra trong phản ứng đó có thể đẩy được 12,7g I2 từ dung dịch NaI.
° Lời giải bài 7 trang 119 SGK Hóa 10:
- Phương trình hóa học của phản ứng:
Cl2 + 2NaI → 2NaCl + I2
- Theo bài ra, ta có: nI2 = 12,7/254 = 0,05 (mol).
- Theo PTPƯ: nCl2 = nI2 = 0,05 (mol).
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
nHCl = 4.nCl2 = 4.0,05 = 0,2 mol.
⇒ Khối lượng HCl cần dùng là: mHCl = 0,2.36,5 = 7,3 (g).
* Bài 11 trang 119 SGK Hóa 10: Cho 300ml một dung dịch có hòa tan 5,85g NaCl tác dụng với 200ml dung dịch có hòa tan 34g AgNO3, người ta thu được một kết tủa và nước lọc.
a) Tính khối lượng chất kết tủa thu được.
b) Tính nồng độ mol chất còn lại trong nước lọc. Cho rằng thể tích nước lọc thu được không thay đổi đáng kể
° Lời giải bài 11 trang 119 SGK Hóa 10:
- Theo bài ra, ta có: nCaCl = 5,85/58,5 = 0,1 (mol). nAgNO3 = 34/170 = 0,2 (mol).
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
- Theo PTPƯ: nAgNO3 pư = nAgCl = nNaCl = 0,1 (mol)
b) Ta có: Vdd = 300 + 200 = 500 (ml).
nAgNO3 dư = 0,2 – 0, 1 = 0,1 (mol); nNaNO3 = nNaCl = 0,1 (mol).
⇒ CM (NaNO3) = CM (AgNO3) = 0,1/0,5 = 0,2 (mol/l).
* Bài 12 trang 119 SGK Hóa 10: Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml dung dịch NaOH 4M (ở nhiệt độ thường).
a) Viết phương trình hóa học của phản ứng xảy ra.
b) Xác định nồng độ mol/l của những chất có trong dung dịch sau phản ứng. Biết rằng tinh thể của dung dịch sau phản ứng thay đổi không đáng kể
° Lời giải bài 12 trang 119 SGK Hóa 10:
- Theo bài ra, ta có: nMnO2 = 69,6/87 = 0,8 (mol); nNaOH = 0,5.4 = 2 (mol).
a) Phương trình hóa học của phản ứng:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (1)
0,8 mol 0,8 0,8
Cl2 + 2NaOH → NaCl + NaClO + H2O (2)
0,8 mol 1,6 0,8 0,8
b) Theo PTPƯ (1): nCl2 = nMnCl2 = nMnO2 = 0,8 (mol).
- Theo PTPƯ (2): nNaCl = nNaClO = nCl2 = 0,8 (mol).
nNaOH pư = 2.nCl2 = 2.0,8 = 1,6 (mol).
⇒ nNaOH dư = 2 - 1,6 = 0,4 (mol).
Nồng độ mol/l của các chất trong dung dịch sau phản ứng là:
⇒ CM (NaCl) = CM (NaClO) = CM(MnCl2) = 0,8/0,5 = 1,6 (mol/l).
⇒ CM (NaOH) dư = 0,4/0,5= 0,8 (mol/l).
Hy vọng với bài viết hệ thống lại kiến thức về tính chất hóa học của nhóm halogen với các nguyên tố flo (F), clo (Cl), brom (Br), iot (I) hữu ích với các em. Mọi thắc mắc và góp ý các em hãy để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét






-
 Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 8 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 7 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 6 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 66 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 71 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 51 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 58 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa học 10 trang 20 - Kết nối tri thức
Giải Hóa học 10 trang 20 - Kết nối tri thức
-
 Giải Hóa học 10 trang 18 - Kết nối tri thức
Giải Hóa học 10 trang 18 - Kết nối tri thức
-
 Giải Hóa học 10 trang 17 - Kết nối tri thức
Giải Hóa học 10 trang 17 - Kết nối tri thức
-
 Giải Hóa học 10 trang 16 - Kết nối tri thức
Giải Hóa học 10 trang 16 - Kết nối tri thức
-
 Giải Hóa học 10 trang 15 - Kết nối tri thức
Giải Hóa học 10 trang 15 - Kết nối tri thức
-
 Giải Hóa học 10 trang 14 - Kết nối tri thức
Giải Hóa học 10 trang 14 - Kết nối tri thức
-
 Giải Hóa học 10 trang 13 - Kết nối tri thức
Giải Hóa học 10 trang 13 - Kết nối tri thức
-
 Giải Hóa học 10 trang 8 - Kết nối tri thức
Giải Hóa học 10 trang 8 - Kết nối tri thức
-
 Giải Hóa học 10 trang 7 - Kết nối tri thức
Giải Hóa học 10 trang 7 - Kết nối tri thức
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK


















































