Giải bài 6 trang 75 SGK Hoá 11: Hợp chất của cacbon, CO, CO2, H2CO3 và muối cacbonat
Nung 52,65 g CaCO3 ở 100oC và cho toàn bộ lượng khí thoát ra hấp thụ hết vào 500,0 ml dung dịch NaOH 1,800M...
Bài 6 trang 75 SGK Hóa 11: Nung 52,65 g CaCO3 ở 100oC và cho toàn bộ lượng khí thoát ra hấp thụ hết vào 500,0 ml dung dịch NaOH 1,800M. Hỏi thu được những muối nào? Khối lượng là bao nhiêu?
Biết rằng hiệu suất phản ứng nhiệt phân CaCO3 là 95%.
Giải bài 6 trang 75 SGK Hóa 11:
- Theo bài ra, ta có: nCaCO3 = m/M = 52,65/100 = 0,5265 (mol).
nNaOH = V.CM = 0,5.1,8 = 0,9 (mol).
- Phương trình hoá học của phản ứng:
CaCO3 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1605058187b9x7ji5two.gif) CaO + CO2
CaO + CO2
- Từ phương trình suy ra:
nCO2 = nCaCO3 = 0,5265 (mol)
Do hiệu suất phản ứng là 95% nên:
nCO2 thực tế = 95%.0,5265 = 0,5 (mol)
- Tỉ lệ mol: 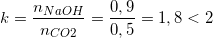
⇒ Tạo ra hỗn hợp 2 muối là Na2CO3 và NaHCO3
CO2 + NaOH → NaHCO3
x x (mol) x (mol)
CO2 + 2NaOH → Na2CO3 + H2O
y 2y (mol) y (mol)

- Theo bài và phương trình phản ứng ta có:
∑nCO2 = x + y = 0,5 (mol).
∑nNaOH = x + 2y = 0,9 (mol).
- Giải hệ trên, ta được: x = 0,1 và y = 0,4
⇒ mNaHCO3 = 0,1.84 = 8,4 (g).
⇒ mNa2CO3 = 0,4.106 = 42,4 (g).
Hy vọng với lời giải bài 6 trang 75 SGK Hoá 11 ở trên đã giúp các em hiểu và nắm vững phần kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Hay Học Hỏi ghi nhận và hỗ trợ, chúc các em học tốt.
• Xem các bài tập Hoá 11 cùng chuyên mục
> Bài 3 trang 75 SGK Hóa 11: Điều nào sau đây không đúng cho phản ứng của khí CO và O2?...
Đánh giá & nhận xét
-
 Giải bài 3 trang 107 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 107 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 107 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 107 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 107 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 107 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 98 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 98 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 98 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 98 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 98 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 98 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 56 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 56 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 51 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 51 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 51 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 51 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 51 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 51 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 4 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 4 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 3 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 3 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 2 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 2 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Giải bài 1 trang 132 Hoá 11 SGK Chân trời sáng tạo
Giải bài 1 trang 132 Hoá 11 SGK Chân trời sáng tạo
-
 Bài 5 trang 91 SGK Hoá 11 Cánh diều
Bài 5 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 91 SGK Hoá 11 Cánh diều
Bài 4 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 91 SGK Hoá 11 Cánh diều: Nhận Biết Ethane, Ethylene, Acetylene
Bài 3 trang 91 SGK Hoá 11 Cánh diều: Nhận Biết Ethane, Ethylene, Acetylene
-
 Bài 2 trang 91 SGK Hoá 11 Cánh diều
Bài 2 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 91 SGK Hoá 11 Cánh diều
Bài 1 trang 91 SGK Hoá 11 Cánh diều
-
 Bài 6 trang 99 SGK Hoá 11 Cánh diều
Bài 6 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 5 trang 99 SGK Hoá 11 Cánh diều
Bài 5 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 99 SGK Hoá 11 Cánh diều
Bài 4 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 99 SGK Hoá 11 Cánh diều
Bài 3 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 2 trang 99 SGK Hoá 11 Cánh diều
Bài 2 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 99 SGK Hoá 11 Cánh diều
Bài 1 trang 99 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen & Nhiệt Hóa Học
Bài 3 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen & Nhiệt Hóa Học
-
 Bài 2 trang 106 SGK Hoá 11 Cánh diều
Bài 2 trang 106 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen
Bài 1 trang 106 SGK Hoá 11 Cánh diều: Dẫn Xuất Halogen
-
 Bài 5 trang 71 SGK Hoá 11 Cánh diều
Bài 5 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 4 trang 71 SGK Hoá 11 Cánh diều
Bài 4 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 3 trang 71 SGK Hoá 11 Cánh diều
Bài 3 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 2 trang 71 SGK Hoá 11 Cánh diều
Bài 2 trang 71 SGK Hoá 11 Cánh diều
-
 Bài 1 trang 71 SGK Hoá 11 Cánh diều
Bài 1 trang 71 SGK Hoá 11 Cánh diều
-
 Giải bài 4 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 4 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 5 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 5 trang 71 Hóa 11 Cánh Diều SGK
-
 Giải bài 3 trang 71 Hóa 11 Cánh Diều SGK
Giải bài 3 trang 71 Hóa 11 Cánh Diều SGK


















































