Tính chất hoá học của Cacbon (C), Cacbon oxit (CO) - Hoá lớp 9 bài 27
Cacbon (C) là một trong những phi kim có nhiều ứng dụng trong đời sống, cacbon có ký hiệu hoá học là C và nguyên tử khối là 12
Cacbon (C) được ứng dụng làm than chì làm điện cực, chất bôi trơn, ruột bút chì. Kim cương được dùng làm đồ trang sức, mũi khoan, dao cắt kính. Than hoạt tính được dùng làm mặt nạ phòng độc, làm chất khử màu, khử mùi. Than đá, than gỗ, được dùng làm nhiên liệu, làm chất khử để điều chế một số kim loại.
Như vậy Cacbon có rất nhiều ứng dụng, trong bài viết này chúng ta cùng tìm hiểu Cacbon có các tính chất vật lý và hoá học gì các bạn nhé.
I. Tính chất hấp thụ của Cacbon (C)
- Than gỗ có tính hấp phụ chất màu tan trong dung dịch.
- Than gỗ có khả năng giữ trên bề mặt của nó các chất khí, chất hơi.
- Than gỗ có tính hấp phụ Than gỗ, than xương ... mới được điều chế có tính hấp phụ cao được gọi là than hoạt tính.
- Than hoạt tính được dùng để làm trắng đường, chế tạo mặt nạ phòng độc...
II. Tính chất hoá học của Cacbon (C)
1. Cacbon tác dụng với oxi
C + O2 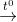 CO2
CO2
2. Cacbon tác dụng với oxit kim loại
2CuO + C 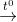 CO2 + 2Cu
CO2 + 2Cu
- Ngoài ra ở nhiệt độ cao, Cacbon có thể khử một số oxit kim loại như PbO, ZnO,... thành kim loại Pb, Zn,...

III. Tính chất hoá học của Cacbon oxit (CO)
1. Tính chất vật lí của Cacbon oxit (CO)
CO là chất khí không màu, không mùi, ít tan trong nước, hơi nhẹ hơn không khí (dCO/kk = 28/29), rất độc.
2. Tính chất hóa học của Cacbon oxit (CO)
a) CO là oxit trung tính
- Ở điều kiện thường CO không phản ứng với nước, axit, bazơ.
b) CO là chất khử
- Ở nhiệt độ cao, CO khử được nhiều oxit kim loại
CO + CuO → CO2 + Cu
2CO + Fe3O4 → 3Fe + 2CO2
2CO + O2 → 2CO2
IV. Tính chất hoá học của Cacbon đioxit (CO2)
1. Tính chất vật lí của cacbon đioxit (CO2)
- CO2 là khí không màu, không mùi, nặng hơn không khí (dCO2/kk = 44/29).
- Người ta có thể rót khí CO2 từ cốc này sang cốc khác. CO2 không duy trì sự sống và sự cháy. CO2 bị nén và làm lạnh thì hóa rắn, được gọi là nước đá khô (tuyết cacbonic). Người ta dùng nước đá khô để bảo quản thực phẩm.
2. Tính chất hóa học của cacbon đioxit (CO2)
a) Cacbon đioxit tác dụng với nước
CO2(k) + H2O (dd) = H2CO3 (dd)
b) Cacbon đioxit tác dụng với dung dịch bazơ
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
- Tùy thuộc vào tỉ lệ giữa số mol CO2 và NaOH mà có thể tạo ra muối trung hòa, muối axit hay cả 2 muối.
c) Cacbon đioxit tác dụng với oxit bazơ
CO2 + CaO → CaCO3
- Như vậy, CO2 có tính chất của một oxit axit.
V. Bài tập về cacbon, cacbon oxit và cacbon đioxit
* Bài 1 trang 84 sgk hoá 9: Dạng thù hình của nguyên tố là gì? Cho hai ví dụ?
>> Giải bài 1 trang 84 sgk hoá 9
* Bài 2 trang 84 sgk hoá 9: Viết phương trình hóa học của cacbon với các oxit sau:
a) CuO. b) PbO.
c) CO2. d) FeO.
>> Giải bài 2 trang 84 sgk hoá 9
* Bài 3 trang 84 sgk hoá 9: Hãy xác định công thức hóa học thích hợp của A, B, C, D trong thí nghiệm ở hình vẽ bên.
Nêu hiện tượng thí nghiệm và viết phương trình hóa học.
>> Giải bài 3 trang 84 sgk hoá 9
* Bài 4 trang 84 sgk hoá 9: Tại sao sử dụng than để đun nấu, nung gạch ngói, nung vôi gây ô nhiễm môi trường. Hãy nêu biện pháp chống ô nhiễm môi trường và giải thích.
>> Giải bài 4 trang 84 sgk hoá 9
* Bài 5 trang 84 sgk hoá 9: Trong công nghiệp, người ta sử dụng cacbon để làm nhiên liệu. Tính nhiệt lượng tỏa ra khi đốt cháy 5kg than đá chứa chứa 90% cacbon, biết rằng 1 mol cacbon cháy thì tỏa ra 394kJ.
Hy vọng với phần hệ thống lại kiến thức về tính chất hoá học của Cacbon (C), Cacbon oxit CO và Cacbon đioxit CO2 ở trên sẽ giúp ích cho các em. Hãy like và chia sẻ nếu thấy có ích, mọi thắc mắc các em hãy để lại bình luận dưới bài viết để được giải đáp. Chúc các em học tốt!
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét


-
 Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
-
 Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 95 Chân trời sáng tạo SGK
Giải KHTN 9 trang 95 Chân trời sáng tạo SGK


















































