Benzen C6H6 tính chất hóa học, công thức cấu tạo và bài tập benzen - hóa 9 bài 39
Benzen C6H6 là chất lỏng, không màu, không tan trong nước, nhẹ hơn nước, benzen độc và có cấu tạo hóa học khác với metan, etilen hay axetilen,...
Vậy Benzen C6H6 có tính chất hóa học, cấu tạo phân tử như thế nào? có ứng dụng gì trong thực tế? chúng ta cùng tìm hiểu qua bài viết này.
• xem thêm: So sánh và nhận biết các hidrocacbon Axetilen, Etilen, Metan, Benzen
I. Tính chất vật lý của Benzen C6H6
- Benzen C6H6 là chất lỏng, không màu, không tan trong nước, nhẹ hơn nước và độc
- Benzen hòa tan nhiều chất như: dầu ăn, cao su, nến, iot,...
II. Công thức cấu tạo của Benzen C6H6
* Công thức cấu tạo C6H6:
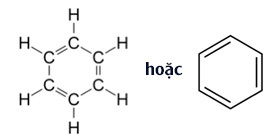
- Từ công thức cấu tạo của benzen, ta thấy sáu nguyên tử cacbon liên kết với nhau tạo thành vòng sáu cạnh đều, có ba liên kết đôi xen kẽ ba liên kết đơn.
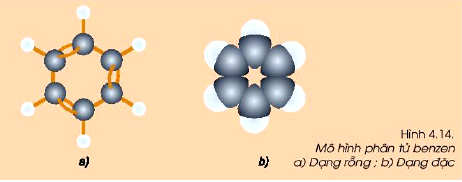
III. Tính chất hóa học của benzen C6H6
1. Benzen tác dụng với oxi:
- Khi đốt benzen cháy trong không khí tạo ra CO2 và H2O, ngọn lửa có nhiều khói đen (muội than) do trong không khí không cung cấp đủ oxi để đốt cháy hoàn toàn benzen.
C6H6 + 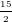 O2
O2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_02/1613645965srfftlng1s.gif) 6CO2 + 3H2O
6CO2 + 3H2O
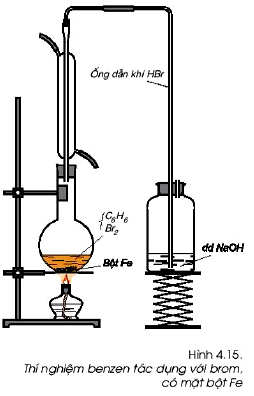
2. Benzen phản ứng thế với với brom:
- Benzen không làm mất màu dung dịch brom như etilen và axetilen. Nó chỉ tham gia phản ứng thế với brom lỏng và cần có xúc tác là bột sắt.
C6H6 (l) + Br2 (l) ![small xrightarrow[]{Fe}](https://hayhochoi.vn/uploads/news/wyswyg/2021_02/16136459669qzl1f8g64.gif) HBr + C6H5Br (brom bezen)
HBr + C6H5Br (brom bezen)
* Lưu ý: Benzen chỉ phản ứng với Brom nguyên chất không phản ứng với dung dịch nước Brom hay benzen không làm mất màu dung dịch brom ở điều kiện thường.
3. Benzen Phản ứng cộng với H2, Cl2
- Benzen khó tham gia phản ứng cộng hơn etilen và axetilen. Tuy nhiên, trong điều kiện thích hợp benzen C6H6 có phản ứng cộng với một số chất như H2, Cl2,…
C6H6 + H2 ![small xrightarrow[]{t^{0},xt}](https://hayhochoi.vn/uploads/news/wyswyg/2021_02/1613645966odkh9qs86l.gif) C6H12
C6H12
C6H6 + Cl2 ![small small xrightarrow[]{as'}](https://hayhochoi.vn/uploads/news/wyswyg/2021_02/1548599455ux7ktmmkvx_1613645966.gif) C6H6Cl6 (Hexacloxiclohexan)
C6H6Cl6 (Hexacloxiclohexan)
- C6H6Cl6 : Hexacloxiclohexan là thuốc trừ sâu 6,6,6
- Do phân tử có cấu tạo đặc biệt nên benzen vừa có phản ứng thế vừa có phản ứng cộng
IV. Ứng dụng của Benzen C6H6
- Benzen là nguyên liệu quan trọng để sản xuất chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu..
-Benzen làm dung môi hòa tan nhiều chất hữu cơ trong công nghiệp và trong phòng thí nghiệm.
V. Bài tập Benzen C6H6
Bài 1 trang 125 sgk hóa 9: Cấu tạo đặc biệt của phân tử benzen là:
a) Phân tử có 6 vòng cạnh.
b) Phân tử có ba liên kết đôi.
c) Phân tử có 6 vòng cạnh chứa ba liên kết đôi xen kẽ ba liên kết đơn.
d) Phân tử có 6 vòng cạnh chứa ba liên kết đôi và ba liên kết đơn.
Hãy chọn câu đúng nhất trong các câu trên.
Lời giải bài 1 trang 125 sgk hóa 9:
- Chọn câu đúng: c) Phân tử có 6 vòng cạnh chứa ba liên kết đôi xen kẽ ba liên kết đơn.
Bài 2 trang 125 sgk hóa 9: Một số học sinh viết công thức cấu tạo của benzen như sau:
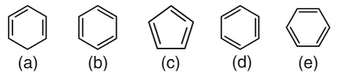
Hãy cho biết công thức nào viết đúng, viết sai, tại sao?
Lời giải bài 2 trang 125 sgk hóa 9:
Công thức cấu tạo đúng của benzen :b), d), e)
(a) sai vì 2 liên kết Pi ở 2 nguyên tử C liền kề nhau (sai về vị trí liên kết đôi)
(c) sai vì có 5 nguyên tử C
Bài 3 trang 125 sgk hóa 9: Cho benzen tác dụng với brom tạo ra brombenzen:
a) Viết phương trình hóa học (có ghi rõ điều kiện phản ứng).
b) Tính khối lượng benzen cần dùng để điều chế 15,7g brombenzen. Biết hiệu suất phản ứng đạt 80%.
Lời giải bài 3 trang 125 sgk hóa 9:
a) Phương trình phản ứng:
C6H6 + Br2 ![small xrightarrow[]{Fe}](https://hayhochoi.vn/uploads/news/wyswyg/2021_02/16136459669qzl1f8g64.gif) C6H5Br + HBr.
C6H5Br + HBr.
b) Theo bài ra, ta có: nC6H5Br = 15,7/157 = 0,1 (mol).
- Theo PTPƯ: nC6H6 = nC6H5Br = 0,1 (mol).
- Do hiệu suất của phản ứng: H = 80% nên: mC6H6 = 0,1.78.(100/80) = 9,75 (g).
Bài 4 trang 125 sgk hóa 9: Hãy cho biết chất nào trong các chất sau đây có thể làm mất màu dung dịch brom. Giải thích và viết phương trình hóa học (nếu có).
a) C6H6.
b) CH2 = CH – CH = CH2.
c) CH3 – C≡CH.
d) CH3 – CH3.
Lời giải bài 4 trang 125 sgk hóa 9:
- Chỉ có chất b) và c) làm mất màu dung dịch brom. Vì trong phân tử có liên kết đôi và liên kết ba tương tự như C2H4 và C2H2.
b) CH2 = CH – CH = CH2 + 2Br2 → CH2Br – CHBr – CHBr – CH2Br.
Hoặc: CH2 = CH – CH = CH2 + Br2 → CH2Br – CHBr – CH = CH2
c) CH3 – C ≡ CH + 2Br2 → CH3 – CBr2 – CHBr2
Hoặc CH3 – C ≡ CH + Br2 → CH3 – CBr = CHBr
Bài 4 trang 129 sgk hoá 9: Đốt cháy V lít khí thiên nhiên chứa 96% CH4 , 2% N2 và 2% CO2 về thể tích. Toàn bộ sản phẩm cháy được dẫn qua dung dịch Ca(OH)2 dư thấy tạo ra 4,9g kết tủa.
a) Viết các phương trình hóa học (biết N2, CO2 không cháy).
b) Tính V (đktc).
Lời giải bài 4 trang 129 sgk hoá 9:
a) Phương trình hoá học của phản ứng đốt cháy:
CH4 + 2O2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_02/1613645967ecdg6k81gl.gif) CO2 + 2H2O (1)
CO2 + 2H2O (1)
- N2 và CO2 không cháy Khi được hấp thụ vào dung dịch,
- Toàn bộ sản phẩm dẫn qua Ca(OH)2 có phản ứng sau:
Ca(OH)2 + CO2 → CaCO3↓+ H2O (2)
- Theo bài ra, thể tích CH4 chiếm 96% nên có: VCH4 = V.(96/100) = 0,96V
- Theo bài ra, thể tích CO2 là:VCH4 = V.(2/100) = 0,02V
- Theo PTPƯ (1) thể tích CO2 tạo ra là 0,96V
⇒ Vậy thể tích CO2 thu được sau khi đốt là 0,96V + 0,02V = 0,98V
⇒ Số mol CO2 thu được là: nCO2 = 0,98V/22,4 (*)
- Theo PTPƯ (2) số mol CaCO3 tạo ra bằng số mol CO2 bị hấp thụ
⇒ nCO2 = nCaCO3 = 4,9/100 = 0,049 (mol) (**)
- Từ (*) và (**) ta có phương trình: 0,98V/22,4 = 0,049
⇒ V = (22,4.0,049)/0,98 = 1,12 (lít)
Hy vọng với bài viết hệ thống lại kiến thức về công thức cấu tạo và tính chất hóa học của benzen C6H6 ở trên hữu ích với các em. Mọi thắc mắc và góp ý các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét






-
 Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
-
 Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 95 Chân trời sáng tạo SGK
Giải KHTN 9 trang 95 Chân trời sáng tạo SGK


















































