Giải Hóa 10 trang 34 Chân trời sáng tạo SGK
Hướng dẫn Giải Hóa 10 trang 34 Chân trời sáng tạo SGK bài 4: Cấu trúc lớp vỏ Electron của nguyên tử, chi tiết dễ hiểu để học sinh tham khảo giải Hóa 10 chân trời ST tốt hơn, giỏi hơn.
Bài 1 trang 34 Hoá 10 Chân trời sáng tạo:
Trong các cách biểu diễn electron vào các orbital của phân lớp 2p ở trạng thái cơ bản, hãy chọn cách phân bố đúng:
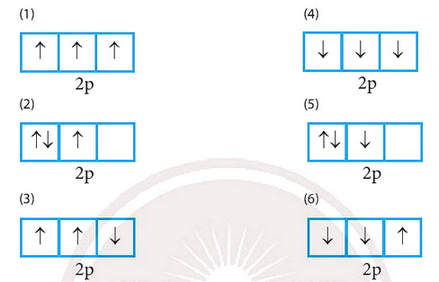
Giải bài 1 trang 34 Hoá 10 Chân trời sáng tạo:
Chọn (1) thỏa mãn vì chứa tối đa electron độc thân, các electron độc thân được biểu diễn bằng mũi tên hướng lên trên.
(2) sai vì chưa thỏa mãn số electron độc thân là tối đa.
(3) sai vì electron độc thân phải được biểu diễn bằng mũi tên hướng lên trên.
(4) sai vì electron độc thân phải được biểu diễn bằng mũi tên hướng lên trên.
(5) sai vì chưa thỏa mãn số electron độc thân là tối đa và electron độc thân phải được biểu diễn bằng mũi tên hướng lên trên.
(6) sai vì electron độc thân phải được biểu diễn bằng mũi tên hướng lên trên.
Bài 2 trang 34 Hoá 10 Chân trời sáng tạo: Cho nguyên tố X có 2 lớp eletron, lớp thứ 2 có 6 electron. Xác định số hiệu nguyên tử của X.
Giải bài 2 trang 34 Hoá 10 Chân trời sáng tạo:
Ta xác định được nguyên tử nguyên tố X lớp thứ nhất có 2 electron, lớp thứ hai có 6 electron nên số electron của nguyên tử của X là 2 + 6 = 8 electron = 8 proton.
Do đó số hiệu nguyên tử của X là 8.
Bài 3 trang 34 Hoá 10 Chân trời sáng tạo: Ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có electron độc thân?
a) Boron
b) Oxygen
c) Phosphorus
d) Chlorine
Giải bài 3 trang 34 Hoá 10 Chân trời sáng tạo:
Ở trạng thái cơ bản, nguyên tử của tất cả các nguyên tố trên đều chứa electron độc thân.
+ Nguyên tử Boron (Z = 5)
Cấu hình electron: 1s22s22p1
Orbital lớp ngoài cùng: 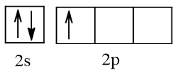
Số electron độc thân: 1
+ Nguyên tử Oxygen (Z = 8)
Cấu hình electron: 1s22s22p4
Orbital lớp ngoài cùng: 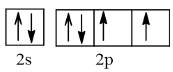
Số electron độc thân: 2
+ Nguyên tử Phosphorus (Z = 15)
Cấu hình electron: 1s22s22p63s23p3
Orbital lớp ngoài cùng: 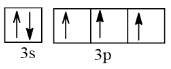
Số electron độc thân: 3
+ Nguyên tử Chlorine (Z = 17)
Cấu hình electron: 1s22s22p63s23p5
Orbital lớp ngoài cùng: 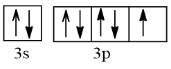
Số electron độc thân: 1
Bài 4 trang 34 Hoá 10 Chân trời sáng tạo:
Viết cấu hình electron nguyên tử của các nguyên tố: carbon (Z = 6), sodium (Z = 11) và oxygen (Z = 8). Cho biết số electron lớp ngoài cùng trong nguyên tử các các nguyên tố trên. Chúng là kim loại, phi kim hay khí hiếm?
Giải bài 4 trang 34 Hoá 10 Chân trời sáng tạo:
+ Carbon (Z = 6): 1s22s22p2
Từ cấu hình electron ⇒ Nguyên tử carbon có 4 electron lớp ngoài cùng
⇒ Carbon là phi kim.
+ Sodium (Z = 11): 1s22s22p63s1
Từ cấu hình electron ⇒ Nguyên tử sodium có 1 electron lớp ngoài cùng
⇒ Sodium là kim loại.
+ Oxygen (Z = 8): 1s22s22p4
Từ cấu hình electron ⇒ Nguyên tử oxygen có 6 electron lớp ngoài cùng
⇒ Oxygen là phi kim.
Với nội dung Giải Hóa 10 trang 34 Chân trời sáng tạo chi tiết, dễ hiểu ở trên. Hay Học Hỏi hy vọng giúp các em nắm vững phương pháp giải bài tập Hóa 10 Chân trời sáng tạo. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để được ghi nhận và hỗ trợ, chúc các em học tốt.
• Xem thêm Giải Hóa 10 Chân trời sáng tạo hay khác
Giải Hóa 10 trang 26 Chân trời sáng tạo SGK
Giải Hóa 10 trang 27 Chân trời sáng tạo SGK
Giải Hóa 10 trang 28 Chân trời sáng tạo SGK
Giải Hóa 10 trang 29 Chân trời sáng tạo SGK
Giải Hóa 10 trang 30 Chân trời sáng tạo SGK
Giải Hóa 10 trang 31 Chân trời sáng tạo SGK
Giải Hóa 10 trang 32 Chân trời sáng tạo SGK
Đánh giá & nhận xét
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 76 Chân trời sáng tạo SGK
Giải Hóa 10 trang 76 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 75 Chân trời sáng tạo SGK
Giải Hóa 10 trang 75 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 74 Chân trời sáng tạo SGK
Giải Hóa 10 trang 74 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 73 Chân trời sáng tạo SGK
Giải Hóa 10 trang 73 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 72 Chân trời sáng tạo SGK
Giải Hóa 10 trang 72 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 71 Chân trời sáng tạo SGK
Giải Hóa 10 trang 71 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 70 Chân trời sáng tạo SGK
Giải Hóa 10 trang 70 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 69 Chân trời sáng tạo SGK
Giải Hóa 10 trang 69 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 68 Chân trời sáng tạo SGK
Giải Hóa 10 trang 68 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 67 Chân trời sáng tạo SGK
Giải Hóa 10 trang 67 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 66 Chân trời sáng tạo SGK
Giải Hóa 10 trang 66 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 65 Chân trời sáng tạo SGK
Giải Hóa 10 trang 65 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 64 Chân trời sáng tạo SGK
Giải Hóa 10 trang 64 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 63 Chân trời sáng tạo SGK
Giải Hóa 10 trang 63 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 62 Chân trời sáng tạo SGK
Giải Hóa 10 trang 62 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 61 Chân trời sáng tạo SGK
Giải Hóa 10 trang 61 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 60 Chân trời sáng tạo SGK
Giải Hóa 10 trang 60 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 59 Chân trời sáng tạo SGK
Giải Hóa 10 trang 59 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 58 Chân trời sáng tạo SGK
Giải Hóa 10 trang 58 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 57 Chân trời sáng tạo SGK
Giải Hóa 10 trang 57 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 56 Chân trời sáng tạo SGK
Giải Hóa 10 trang 56 Chân trời sáng tạo SGK


















































