Giải bài 5 trang 25 SGK Hoá 9: Tính chất hoá học của Bazơ
Cho 15,5g natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.....
Bài 5 trang 25 SGK Hóa 9: Cho 15,5g natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu được.
b) Tính thể tích dung dịch H2SO4 20%, có khối lượng riêng 1,4 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
Giải bài 5 trang 25 SGK Hóa 9:
- Theo bài ra, ta có: nNa2O = m/M = 15,5/62 = 0,25 (mol).
a) Phương trình phản ứng:
Na2O + H2O → 2NaOH
- Theo PTPƯ: nNaOH = 2.nNa2O = 2.0,25 = 0,5 (mol).
- Nồng độ mol của dd bazo là:
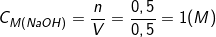
b) Phương trình phản ứng:
2NaOH + H2SO4 → Na2SO4 + 2H2O
- Theo PTPƯ:
nH2SO4 = (1/2).nNaOH = (1/2).0,5 = 0,25 (mol).
⇒ mH2SO4 = n.M = 0,25.98 = 24,5 (g).
- Từ công thức tính nồng độ phần trăm của dd:
C%=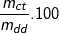 % ⇒ mdd (H2SO4) = mct/C%
% ⇒ mdd (H2SO4) = mct/C%
= (24,5/20%) = (24,5.100)/20 = 122,5 (g).
- Ta lại có, khối lượng riêng:
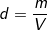
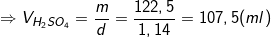
Hy vọng với lời giải bài 5 trang 25 SGK Hoá 9: Cho 15,5g natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ...? ở trên đã giúp các em hiểu và nắm vững phần kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Hay Học Hỏi ghi nhận và hỗ trợ, chúc các em học tốt.
• Xem các bài tập Hoá 9 cùng chuyên mục
Đánh giá & nhận xét
-
 Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
-
 Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 95 Chân trời sáng tạo SGK
Giải KHTN 9 trang 95 Chân trời sáng tạo SGK


















































