Giải Hóa 10 Chân trời sáng tạo trang 111
Hướng dẫn Giải Hóa 10 Chân trời sáng tạo trang 111 với nội dung SGK bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA, chi tiết dễ hiểu để học sinh tham khảo giải Hóa 10 chân trời ST tốt hơn, giỏi hơn.
Câu hỏi 12 trang 111 Chân trời Sáng tạo:
Tiến hành thí nghiệm 1, quan sát và ghi nhận hiện tượng.
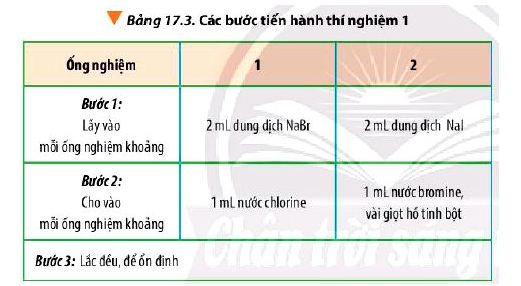
Thí nghiệm 1: So sánh tính chất hóa học của halogen
Hóa chất: dung dịch NaBr, NaI, nước chlorine, nước bromine và dung dịch hồ tinh bột.
Dụng cụ: ống nghiệm, ống hút nhỏ giọt, kẹp gỗ, giá để ống nghiệm.
Tiến hành: Thực hiện các bước theo Bảng 17.3
Lời giải:
Hiện tượng:
- Ống nghiệm 1: Dung dịch từ không màu chuyển sang màu vàng.
- Ống nghiệm 2: Dung dịch không màu chuyển thành màu vàng, có hơi màu tím thoát ra. Khi cho thêm hồ tinh bột vào thấy dung dịch chuyển sang màu xanh tím.

Câu hỏi 13 trang 111 Chân trời Sáng tạo:
Dựa vào phương trình hóa học của các phản ứng, giải thích kết quả thí nghiệm 1.
Lời giải:
Giải thích kết quả thí nghiệm 1:
- Ống nghiệm 1: Dung dịch NaBr không màu của chuyển sang màu vàng của Br2 do có phản ứng.
Cl2 + 2NaBr → 2NaCl + Br2
- Ống nghiệm 2: Dung dịch NaI không màu chuyển thành màu vàng, có hơi màu tím thoát ra. Khi cho thêm hồ tinh bột vào thấy dung dịch chuyển sang màu xanh tím do I2 gặp hồ tinh bột.
Br2 + 2NaI → 2NaBr + I2
Câu hỏi 14 trang 111 Chân trời Sáng tạo:
Tiến hành thí nghiệm 2, quan sát và ghi nhận hiện tượng.
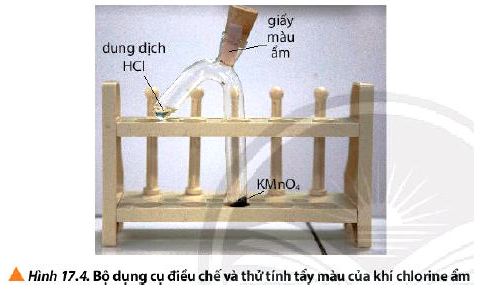
Thí nghiệm 2: Tính tẩy màu của khí chlorine ẩm
Hóa chất: tinh thể potassium permanganate (KMnO4), dung dịch HCl đặc, giấy màu, nước cất.
Dụng cụ: ống nghiệm 2 nhánh, nút cao su, giá đỡ, thìa thủy tinh, ống hút nhỏ giọt.
Tiến hành:
Bước 1: Dùng thìa thủy tinh lấy một ít tinh thể KMnO4, cho vào nhánh dài của ống nghiệm. Dùng ống hút nhỏ giọt lấy khoảng 1 mL dung dịch HCl đặc cho vào nhánh ngắn của ống nghiệm. Lắp dụng cụ để điều chế khí Cl2 ẩm như Hình 17.4.
Lưu ý: Kiểm tra nút cao su phải được đậy kín trước khi thực hiện bước 2.
Bước 2: Nghiêng ống nghiệm sao cho dung dịch HCl tiếp xúc với KMnO4.
Phương trình hóa học của phản ứng điều chế khí Cl2:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
Lời giải:
Hiện tượng: KMnO4 tan trong HCl và KMnO4 bị mất màu. Có khí màu vàng lục thoát ra làm giấy màu ẩm bị mất màu.
Với nội dung Giải Hóa 10 SGK Chân trời sáng tạo trang 111 chi tiết, dễ hiểu ở trên. Hay Học Hỏi hy vọng giúp các em nắm vững phương pháp giải Hóa 10 Chân trời sáng tạo. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để được ghi nhận và hỗ trợ, chúc các em học tốt.
• Xem thêm Giải Hóa 10 Chân trời sáng tạo bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Giải Hóa 10 Chân trời sáng tạo trang 105
Giải Hóa 10 Chân trời sáng tạo trang 106
Giải Hóa 10 Chân trời sáng tạo trang 107
Giải Hóa 10 Chân trời sáng tạo trang 108
Giải Hóa 10 Chân trời sáng tạo trang 109
Giải Hóa 10 Chân trời sáng tạo trang 110
Giải Hóa 10 Chân trời sáng tạo trang 111
Đánh giá & nhận xét
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
Giải Hóa 10 trang 79 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
Giải Hóa 10 trang 78 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
Giải Hóa 10 trang 77 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 76 Chân trời sáng tạo SGK
Giải Hóa 10 trang 76 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 75 Chân trời sáng tạo SGK
Giải Hóa 10 trang 75 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 74 Chân trời sáng tạo SGK
Giải Hóa 10 trang 74 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 73 Chân trời sáng tạo SGK
Giải Hóa 10 trang 73 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 72 Chân trời sáng tạo SGK
Giải Hóa 10 trang 72 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 71 Chân trời sáng tạo SGK
Giải Hóa 10 trang 71 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 70 Chân trời sáng tạo SGK
Giải Hóa 10 trang 70 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 69 Chân trời sáng tạo SGK
Giải Hóa 10 trang 69 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 68 Chân trời sáng tạo SGK
Giải Hóa 10 trang 68 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 67 Chân trời sáng tạo SGK
Giải Hóa 10 trang 67 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 66 Chân trời sáng tạo SGK
Giải Hóa 10 trang 66 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 65 Chân trời sáng tạo SGK
Giải Hóa 10 trang 65 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 64 Chân trời sáng tạo SGK
Giải Hóa 10 trang 64 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 63 Chân trời sáng tạo SGK
Giải Hóa 10 trang 63 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 62 Chân trời sáng tạo SGK
Giải Hóa 10 trang 62 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 61 Chân trời sáng tạo SGK
Giải Hóa 10 trang 61 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 60 Chân trời sáng tạo SGK
Giải Hóa 10 trang 60 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 59 Chân trời sáng tạo SGK
Giải Hóa 10 trang 59 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 58 Chân trời sáng tạo SGK
Giải Hóa 10 trang 58 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 57 Chân trời sáng tạo SGK
Giải Hóa 10 trang 57 Chân trời sáng tạo SGK
-
 Giải Hóa 10 trang 56 Chân trời sáng tạo SGK
Giải Hóa 10 trang 56 Chân trời sáng tạo SGK


















































