Định luật bảo toàn Khối lượng, Công thức tính và Bài tập vận dụng - Hóa 8 bài 15
Định luật bảo toàn khối lượng là một trong những định luật quan trọng mà các em được học trong chương trình hóa học lớp 8, đây là nội dung nền tảng trong nhiều phương pháp giải các bài tập về hóa học.
Vậy nội dụng của định luật bảo toàn khối lượng được phát biểu như thế nào? Công thức tính của định luật bảo toàn khối lượng viết ra sao? vận dụng định luật bảo toàn để giải các bài tập hóa học như thế nào? chúng ta cùng tìm hiểu qua bài viết dưới dây.
I. Thí nghiệm
• Thực hiện thí nghiệm như sau:
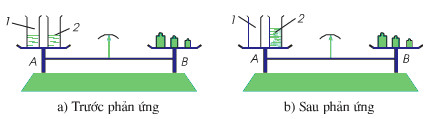 Phản ứng hóa học trong cốc trên đĩa cân
Phản ứng hóa học trong cốc trên đĩa cân
- Đặt 2 cốc chứa dd BaCl2 và Na2SO4 lên 1 đĩa cân
- Đặt các quả cân lên đĩa cân còn lại.
- Đổ cốc đựng dung dịch BaCl2 vào cốc đựng dung dịch Na2SO4
• Quan sát thấy, có chất màu trắng xuất hiện, đó là bari sunfat BaSO4, chất này không tan, đã xảy ra phản ứng hóa học sau:
Bari clorua + Natri sunfat → Bari sunfat + Natri clorua
• Kim cân ở vị trí thăng bằng.
II. Định luật bảo toàn khối lượng
• Phát biểu định luật bảo toàn khối lượng: Trong một phản ứng hóa học, tổng khối lượng các chất sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
• Lưu ý: Trong phản ứng hóa học liên kết giữa các nguyên tử bị thay đổi. Số nguyên tử của mỗi nguyên tố giữ nguyên và khối lượng của các nguyên tử không đổi (được bảo toàn).
III. Áp dụng định luật bảo toàn khối lượng
- Giả sử có phương trình phản ứng: A + B → C + D
- Công thức tính của định luật bảo toàn khối lượng như sau:
mA + mB → mC + mD
Trong đó: mA; mB; mC; mD là khối lượng của mỗi chất.
Thí dụ, công thức về khối lượng của các chất phản ứng trong thí nghiệm là:
mBaCl2 + mNa2SO4 = mBaSO4 + mNaCl
- Trong công thức này, nếu biết khối lượng của 3 chất thì ta tính được khối lượng của chất còn lại. Gọi a, b, c lần lượt là khối lượng của Bari Clorua, Natri Sunfat và Natri Clorua. Và x là số mol của Bari Sunfat.
Ta có: a + b = c + x suy ra x = a + b - c;...
* Ví dụ: Cho 4g NaOH tác dụng với 8g CuSO4 tạo ra 4,9g Cu(OH)2 kết tủa và Na2SO4. Tính khối lượng Na2SO4.
* Lời giải:
Áp dụng ĐLBT khối lượng, ta có:
mNaOH + mCuSO4 = mCu(OH)2 + mNa2SO4
⇒ mNa2SO4 = mNaOH + mCuSO4 - mCu(OH)2
Suy ra: mNa2SO4 = 4 + 8 - 4,9 = 7,1(g)
IV. Bài tập vận dụng định luật bảo toàn khối lượng
* Bài 1 trang 54 SGK Hóa học 8: a) Phát biểu định luật bảo toàn khối lượng.
b) Giải thích vì sao khi một phản ứng hóa học xảy ra khối lượng được bảo toàn.
>> Giải bài 1 trang 54 SGK Hóa học 8
* Bài 2 trang 54 SGK Hóa học 8: Trong phản ứng ở thí nghiệm trên, cho biết khối lượng của natri sunfat Na2SO4 là 14,2g khối lượng của các sản phẩm bari sunfat BaSO4 và natri clorua NaCl theo thứ tự là 23,3g và 11,7g.
Hãy tính khối lượng của Bari clorua BaCl2 đã phản ứng.
* Bài 3 trang 54 SGK Hóa học 8: Đốt cháy hết 9g kim loại magie Mg trong không khí thu được 15g hợp chất magie oxit MgO. Biết rằng magie cháy là phản ứng với khí oxi O2 trong không khí.
a) Viết công thức về khối lượng của phản ứng xảy ra.
b) Tính khối lượng của khí oxi đã phản ứng.
>> Giải bài 3 trang 54 SGK Hóa học 8
Hy vọng với bài viết về Định luật bảo toàn Khối lượng, Công thức tính và Bài tập vận dụng ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để hayhochoi ghinhanaj và hỗ trợ, chúc các em học tốt.
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét







-
 Bài tập luyện tập về điều chế HIDRO và phản ứng thế, phản ứng OXI HÓA KHỬ - Hóa 8 bài 34
Bài tập luyện tập về điều chế HIDRO và phản ứng thế, phản ứng OXI HÓA KHỬ - Hóa 8 bài 34
-
 Tỉ khối là gì, công thức và cách tính tỉ khối của chất khí, hỗn hợp khí - hoá 8 bài 20
Tỉ khối là gì, công thức và cách tính tỉ khối của chất khí, hỗn hợp khí - hoá 8 bài 20
-
 Cách lập phương trình hóa học, ý nghĩa của phương trình hóa học và Bài tập - Hóa 8 bài 16
Cách lập phương trình hóa học, ý nghĩa của phương trình hóa học và Bài tập - Hóa 8 bài 16
-
 Hóa trị là gì? Quy tắc, cách tính hóa trị và bảng hóa trị nguyên tố (Hóa 8 bài 10)
Hóa trị là gì? Quy tắc, cách tính hóa trị và bảng hóa trị nguyên tố (Hóa 8 bài 10)
-
 Màu sắc một số chất kết tủa và dung dịch thường gặp trong hóa học
Màu sắc một số chất kết tủa và dung dịch thường gặp trong hóa học
-
 Bảng tính tan trong nước của một số chất? Hỏi đáp Hóa học 8
Bảng tính tan trong nước của một số chất? Hỏi đáp Hóa học 8
-
 Công thức tính độ tan S (lớp 8) của một chất trong nước? Hỏi đáp Hóa học 8
Công thức tính độ tan S (lớp 8) của một chất trong nước? Hỏi đáp Hóa học 8
-
 Bảng hóa trị của các nguyên tố hóa học và Bảng hóa trị của một số nhóm nguyên tử - Hóa lớp 8
Bảng hóa trị của các nguyên tố hóa học và Bảng hóa trị của một số nhóm nguyên tử - Hóa lớp 8
-
 Giải bài 1 trang 79 SGK Hoá 8: Luyện tập mol, khối lượng mol, thể tích mol, tỉ khối chất khí
Giải bài 1 trang 79 SGK Hoá 8: Luyện tập mol, khối lượng mol, thể tích mol, tỉ khối chất khí
-
 Giải bài 1 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 1 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 2 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 2 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 3 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 3 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 4 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 4 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 5 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 5 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 6 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 6 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 7 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 7 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 8 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 8 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 1 trang 131 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 1 trang 131 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 2 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 2 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 3 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 3 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 4 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 4 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 5 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 5 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 1 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 1 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 2 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 2 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 3 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 3 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 4 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 4 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 5 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 5 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 1 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 1 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 2 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 2 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 3 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 3 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 6 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 6 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 5 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 5 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 4 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 4 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Nồng độ Mol, Nồng độ phần trăm của dung dịch: Bài tập luyện tập - Hóa 8 bài 44
Nồng độ Mol, Nồng độ phần trăm của dung dịch: Bài tập luyện tập - Hóa 8 bài 44
-
 Cách Pha chế dung dịch theo nồng đồ cho trước và Cách tính để pha loãng dung dịch - Hóa 8 bài 43
Cách Pha chế dung dịch theo nồng đồ cho trước và Cách tính để pha loãng dung dịch - Hóa 8 bài 43
-
 Axit, Bazơ, Muối và Nước: Bài tập luyện tập về Axit Bazơ Muối - Hóa 8 bài 38
Axit, Bazơ, Muối và Nước: Bài tập luyện tập về Axit Bazơ Muối - Hóa 8 bài 38
-
 Bài tập luyện tập về Oxi, Oxit, Sự Oxi hóa, Phản ứng hóa hợp và phản ứng phân hủy - Hóa 8 bài 29
Bài tập luyện tập về Oxi, Oxit, Sự Oxi hóa, Phản ứng hóa hợp và phản ứng phân hủy - Hóa 8 bài 29
-
 Giải bài 4 trang 75 SGK Hoá 8: Cách tính theo phương trình hoá học
Giải bài 4 trang 75 SGK Hoá 8: Cách tính theo phương trình hoá học
-
 Giải bài 2 trang 60 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
Giải bài 2 trang 60 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng


















































