Giải bài 5 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Nhôm (III) oxit tác dụng với axit sunfuric theo phương trình phản ứng sau:...
Bài 5 trang 132 SGK Hóa 8: Nhôm (III) oxit tác dụng với axit sunfuric theo phương trình phản ứng sau:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tính lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49g axit sunfuric nguyên chất tác dụng với 60g nhôm oxit. Sau phản ứng chất nào còn dư ? Lượng dư của chất đó là bao nhiêu?
Giải Bài 5 trang 132 SGK Hóa 8:
Phương trình hóa học của phản ứng:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
1mol 3mol 1mol 3mol
Theo bài ra, ta có:
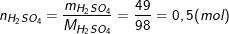
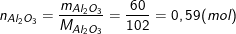
So sánh tỉ lệ số mol Al2O3 và H2SO4 theo số mol bài cho trên số mol theo tỉ lệ phản ứng ta có:
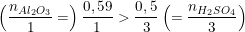
→ Vậy Al2O3 dư, H2SO4 hết. Số mol sản phẩm thu được tính theo số mol H2SO4.

- Theo PTHH có số mol nhôm sunfat là:
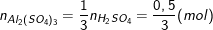
Nên khối lượng nhôm sunfat là:
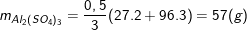
- Số mol nhôm oxit tham gia phản ứng là:
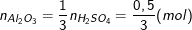
Nên khối lượng nhôm oxit tham gia pư là:
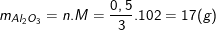
Vậy khối lượng nhôm oxit dư là:
mAl2O3 (dư) = 60 - 17 = 43(g).
Hy vọng với lời giải bài 5 trang 132 SGK Hoá 8 ở trên đã giúp các em hiểu và nắm vững phần kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Hay Học Hỏi ghi nhận và hỗ trợ, chúc các em học tốt.
• Xem các bài tập Hoá 8 cùng chuyên mục
Đánh giá & nhận xét
-
 Bài tập luyện tập về điều chế HIDRO và phản ứng thế, phản ứng OXI HÓA KHỬ - Hóa 8 bài 34
Bài tập luyện tập về điều chế HIDRO và phản ứng thế, phản ứng OXI HÓA KHỬ - Hóa 8 bài 34
-
 Tỉ khối là gì, công thức và cách tính tỉ khối của chất khí, hỗn hợp khí - hoá 8 bài 20
Tỉ khối là gì, công thức và cách tính tỉ khối của chất khí, hỗn hợp khí - hoá 8 bài 20
-
 Cách lập phương trình hóa học, ý nghĩa của phương trình hóa học và Bài tập - Hóa 8 bài 16
Cách lập phương trình hóa học, ý nghĩa của phương trình hóa học và Bài tập - Hóa 8 bài 16
-
 Hóa trị là gì? Quy tắc, cách tính hóa trị và bảng hóa trị nguyên tố (Hóa 8 bài 10)
Hóa trị là gì? Quy tắc, cách tính hóa trị và bảng hóa trị nguyên tố (Hóa 8 bài 10)
-
 Màu sắc một số chất kết tủa và dung dịch thường gặp trong hóa học
Màu sắc một số chất kết tủa và dung dịch thường gặp trong hóa học
-
 Bảng tính tan trong nước của một số chất? Hỏi đáp Hóa học 8
Bảng tính tan trong nước của một số chất? Hỏi đáp Hóa học 8
-
 Công thức tính độ tan S (lớp 8) của một chất trong nước? Hỏi đáp Hóa học 8
Công thức tính độ tan S (lớp 8) của một chất trong nước? Hỏi đáp Hóa học 8
-
 Bảng hóa trị của các nguyên tố hóa học và Bảng hóa trị của một số nhóm nguyên tử - Hóa lớp 8
Bảng hóa trị của các nguyên tố hóa học và Bảng hóa trị của một số nhóm nguyên tử - Hóa lớp 8
-
 Giải bài 1 trang 79 SGK Hoá 8: Luyện tập mol, khối lượng mol, thể tích mol, tỉ khối chất khí
Giải bài 1 trang 79 SGK Hoá 8: Luyện tập mol, khối lượng mol, thể tích mol, tỉ khối chất khí
-
 Giải bài 1 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 1 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 2 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 2 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 3 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 3 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 4 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 4 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 5 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 5 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 6 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 6 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 7 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 7 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 8 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 8 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 1 trang 131 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 1 trang 131 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 2 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 2 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 3 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 3 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 4 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 4 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 1 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 1 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 2 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 2 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 3 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 3 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 4 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 4 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 5 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 5 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 1 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 1 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 2 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 2 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 3 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 3 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 6 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 6 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 5 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 5 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 4 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 4 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Nồng độ Mol, Nồng độ phần trăm của dung dịch: Bài tập luyện tập - Hóa 8 bài 44
Nồng độ Mol, Nồng độ phần trăm của dung dịch: Bài tập luyện tập - Hóa 8 bài 44
-
 Cách Pha chế dung dịch theo nồng đồ cho trước và Cách tính để pha loãng dung dịch - Hóa 8 bài 43
Cách Pha chế dung dịch theo nồng đồ cho trước và Cách tính để pha loãng dung dịch - Hóa 8 bài 43
-
 Axit, Bazơ, Muối và Nước: Bài tập luyện tập về Axit Bazơ Muối - Hóa 8 bài 38
Axit, Bazơ, Muối và Nước: Bài tập luyện tập về Axit Bazơ Muối - Hóa 8 bài 38
-
 Bài tập luyện tập về Oxi, Oxit, Sự Oxi hóa, Phản ứng hóa hợp và phản ứng phân hủy - Hóa 8 bài 29
Bài tập luyện tập về Oxi, Oxit, Sự Oxi hóa, Phản ứng hóa hợp và phản ứng phân hủy - Hóa 8 bài 29
-
 Giải bài 4 trang 75 SGK Hoá 8: Cách tính theo phương trình hoá học
Giải bài 4 trang 75 SGK Hoá 8: Cách tính theo phương trình hoá học
-
 Giải bài 2 trang 60 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
Giải bài 2 trang 60 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
-
 Giải bài 1 trang 60 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
Giải bài 1 trang 60 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng


















































