Bài tập Axit tác dụng với Bazơ và cách giải - Hóa 9 chuyên đề
Axit và Bazơ là những hợp chất vô cơ phổ biến, chính vì vậy mà dạng bài tập này khá phong phú và rất hay gặp trong các bài tập hóa 9.
Vậy cách giải Bài tập axit tác dụng với bazơ như thế nào? nội dung bài viết dưới đây sẽ giúp các em nắm vững lý thuyết về axit bazơ qua đó giúp các em hiểu và dễ dàng giải một số dạng bài tập về axit tác dụng với bazơ khi gặp, để đạt kết quả cao trong học tập.
I. Lý thuyết và cách giải bài tập Axit tác dụng với Bazơ
1. Phản ứng axit tác dụng với bazơ
- Phản ứng axit tác dụng với bazơ là phản ứng trung hòa
- Axit tác dụng với Bazơ tạo thành Muối và Nước
Phương trình phản ứng: Axit + bazơ → muối + nước
* Ví dụ:
H2SO4 + 2KOH → K2SO4 + 2H2O
2HCl + Ba(OH)2 → BaCl2 + 2H2O
2. Phương pháp giải dạng bài tập Axit tác dụng với Bazơ
Để giải bài tập Axit tác dụng với bazơ, chúng ta thực hiện 4 bước như sau:
- Bước 1: Tính số mol các chất đề bài đã cho số liệu
- Bước 2: Viết phương trình phản ứng hóa học xảy ra.
- Bước 3: Tính toán luôn theo phương trình phản ứng hóa học hoặc đặt ẩn nếu đề bài toán là hỗn hợp.
- Bước 4: Lập phương trình toán học và giải phương trình tính số mol các chất cần tìm.
- Bước 5: Tính toán theo yêu cầu đề bài.
* Lưu ý: Trong một hỗn hợp mà có nhiều phản ứng xảy ra thì phản ứng trung hoà được ưu tiên xảy ra trước.
* Đặc biệt, với bài toán cụ thể sau:
• Cho từ từ dung dịch H2SO4 vào dung dịch NaOH thì có các phản ứng xảy ra:
Phản ứng ưu tiên tạo ra muối trung hoà trước.
H2SO4 + 2NaOH → Na2SO4 + H2O (1)
Sau đó khi số mol H2SO4 = số mol NaOH thì có phản ứng
H2SO4 + NaOH → NaHSO4 + H2O (2)
+) Cách giải: Ta xét tỷ lệ số mol để viết PTHH xảy ra.
Đặt T = nNaOH : nH2SO4
° Nếu T ≤ 1 thì chỉ có phản ứng (2) xảy ra, tạo muối axit NaHSO4 và có thể dư H2SO4.
° Nếu T ≥ 2 thì chỉ có phản ứng (1) tạo muối trung hòa Na2SO4 và có thể dư NaOH.
° Nếu 1 < T < 2 thì có cả 2 phản ứng (1) và (2) ở trên.
• Ngược lại:
* Cho từ từ dung dịch NaOH vào dung dịch H2SO4 thì có các phản ứng xảy ra:
Phản ứng ưu tiên tạo ra muối axit trước.
H2SO4 + NaOH → NaHSO4 + H2O (1)
Và sau đó:
NaOH (dư) + NaHSO4 → Na2SO4 + H2O (2)
Hoặc dựa vào số mol H2SO4 và số mol NaOH hoặc số mol Na2SO4 và NaHSO4 tạo thành sau phản ứng để lập các phương trình toán học và giải.
Đặt ẩn x, y lần lượt là số mol của Na2SO4 và NaHSO4 tạo thành sau phản ứng.
II. Bài tập về axit tác dụng với bazơ
* Bài tập 1: Cần dùng bao nhiêu ml dung dịch KOH 1,5M để trung hòa hết 300ml dung dịch HCl 1M.
* Bài giải:
- Đổi đơn vị: 300ml = 0,3 lít.
- Theo bài ra, ta có: nHCl = CM.V = 1.0,3 = 0,3 mol;
- Phương trình phản ứng hóa học:
KOH + HCl → KCl + H2O
ptpư: 1(mol) 1(mol)
bài ra: x ← 0,3(mol)
Theo phương trình phản ứng: 1 mol KOH cần 1 mol HCl để trung hòa
Theo bài ra, x mol KOH cần 0,3 mol HCl để trung hòa
⇒ x = 0,3(mol)
Từ công thức: CM(KOH) = nKOH/VKOH
Suy ra, thể tích KOH cần dùng là:
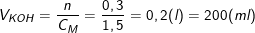
* Bài tập 2: Cần dùng bao nhiêu ml dung dịch KOH 1,5M để trung hoà 300ml dung dịch A chứa H2SO4 0,75M và HCl 1,5M.
* Lời giải:
- Đổi đơn vị: 300ml = 0,3lít;
- Theo bài ra, nH2SO4 = 0,3.0,75 = 0,225(mol);
nHCl = 0,3.1,5 = 0,45(mol);
- Phương trình phản ứng hóa học:
KOH + HCl → KCl + H2O
0,45 ← 0,45(mol)
2KOH + H2SO4 → K2SO4 + H2O
0,45 ← 0,225(mol)
Như vậy theo PTPƯ thì tổng số mol KOH cần là:
nKOH = 0,45 + 0,45 = 0,9(mol)
Từ công thức: CM(KOH) = nKOH/VKOH
Suy ra, thể tích KOH cần dùng là:
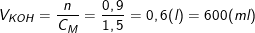
* Bài tập 3: Cần bao nhiêu ml dung dịch NaOH 0,75M để trung hòa 400ml hỗn hợp dung dịch axit gồm H2SO4 0,5M và HCl 1M.
* Lời giải:
- Đổi đơn vị: 400ml = 0,4lít;
- Theo bài ra, ta có: nH2SO4 = 0,4.0,5 = 0,2 (mol);
nHCl = 0,4.1 = 0,4 (mol);
- Phương trình phản ứng hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,4 ← 0,2(mol)
NaOH + HCl → NaCl + H2O
0,4 ← 0,4 (mol)
Như vậy, theo phương trình phản ứng ta có tổng số mol NaOH là:
nNaOH = 0,4 + 0,4 = 0,8 (mol).
⇒ V(NaOH) = 0,8/0,75 = 1,07 (l) = 1070(ml).
* Bài tập 4: Để trung hoà 10ml dung dịch hỗn hợp axit gồm H2SO4 và HCl cần dùng 40ml dung dịch NaOH 0,5M. Mặt khác lấy 100ml dung dịch axit đem trung hoà một lượng xút vừa đủ rồi cô cạn thì thu được 13,2g muối khan. Tính nồng độ mol/l của mỗi axít trong dung dịch ban đầu.
* Lời giải:
- Đổi đơn vị: 10ml = 0,01lít; 40ml = 0,04lít;
- Theo bài ra, ta có: nNaOH = 0,04.0,5 = 0,02(mol);
- Gọi x, y lần lượt là số mol của axit H2SO4 và HCl
- Phương trình phản ứng:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
x(mol) → 2x x
HCl + NaOH → NaCl + H2O
y(mol) → y y
Theo bài ra và theo PTPƯ, ta có:
nNaOH = 2x + y = 0,02 (mol) (*)
mNa2SO4 + mNaCl = 142x + 58,5y = 1,32 (**)
(do tỉ lệ thể tích của HCl là 100ml, gấp 10 lần ban đầu nên số gam muối thu được 13,2g gấp 10 lần HCl phản ứng NaOH ban đầu)
Giải hệ (*) và (**) ta được: x=0,006 (mol); y = 0,008(mol)
Vậy nồng độ mol của HCl (10ml) là:
CM(HCl) = n/V = 0,008/0,01 = 0,8M
CM(H2SO4) = n/V = 0,006/0,01 = 0,6M
* Bài tập 5: Khi cho 800ml dung dịch NaOH 1M tác dụng hết với dung dịch H2SO4 1M tạo thành muối trung hòa. Tính thể tích dung dịch H2SO4 1M.
* Hướng dẫn:
- Ta có: nNaOH = V.CM = 0,8.1 = 0,8 (mol).
- Phương trình phản ứng hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,8 → 0,4 (mol)
⇒ VH2SO4= n/CM = 0,4/1 = 0,4 (lít).
* Bài tập 6: Cho 150ml dd Ba(OH)2 1M vào 100ml dd H2SO4 1M. Tính khối lượng kết tủa thu được.
* Hướng dẫn:
Ta có: nBa(OH)2 = 0,15 mol
nH2SO4 = 0,1 mol
Phương trình phản ứng hóa học :
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
0,15 0,1(mol)
Ta có tỉ lệ mol: 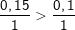 ⇒ Ba(OH)2 dư, H2SO4 hết.
⇒ Ba(OH)2 dư, H2SO4 hết.
⇒ Sô mol PTPƯ tính theo số mol của H2SO4 nên:
Số mol kết tủa thu được là: nBaSO4↓ = nH2SO4 = 0,1(mol)
⇒ Khối lượng kết tủa thu được: mBaSO4↓ = 0,1.233 = 23,3(g)
Hy vọng với bài viết Bài tập Axit tác dụng với Bazơ và cách giải ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để hayhochoi ghi nhận và hỗ trợ, chúc các em học tốt.
Đánh giá & nhận xét


-
 Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
-
 Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 95 Chân trời sáng tạo SGK
Giải KHTN 9 trang 95 Chân trời sáng tạo SGK


















































