Cách giải bài toán tăng giảm khối lượng - Hóa 9 chuyên đề
Bài toán tăng giảm khối lượng là một trong những dạng toán phổ biến trong các phản ứng trao đổi giữa các dung dịch muối hay dung dịch muối tác dụng với axit.
Vậy cách giải bài toán tăng giảm khối lượng hóa học 9 như thế nào? Hãy cùng hay học hỏi tìm hiểu qua vài viết dưới đây nhé.
I. Cách giải bài toán tăng giảm khối lượng
1. Bài toán tăng giảm khối lượng giữa muối clorua của kim loại Ba, Ca, Mg tác dụng với natri cacbonat.
- Cho a gam muối clorua (của kim loại Ba, Ca, Mg) tác dụng với muối Na2CO3 tạo muối cacsbonat có khối lượng b gam. Hãy tính khối lượng muối clorua của kim loại?
- Để giải bài toán này, ta phải tìm số mol (n) của muối như sau:
Độ giảm khối lượng muối = a - b; là do Cl2 (71) thay bằng CO3 (60).
Tìm: nmuối = (a - b)/(71 - 60) = (Độ tăng khối lượng theo đề bài)/(Độ tăng khối lượng muối theo phương trình).
* Lưu ý: Phải so sánh nmuối với nNa2CO3 để xem chất nào hết, chất nào dư.

2. Bài toán tăng giảm khối lượng giữa muối cacbonat của kim loại hóa trị II tác dụng với axit H2SO4 loãng dư
- Bài toán cho m gam muối cacbonat của kim loại hóa trị II tác dụng với axit H2SO4 loãng dư thu được n gam muối sunfat. Hãy tìm công thức phân tử muối cacbonat?
- Muốn tìm công thức muối cacbonat ta phải tìm số mol muối:
nmuối = (n - m)/(96 - 60) ; do thay muối cacbonat CO3 (60) bằng muối sunfat SO4 (96).
Xác định công thức phân tử của muối (MCO3):
M + 60 = m/nmuối ⇒ M = ?
3. Dạng bài tập tăng giảm khối lượng khi cho kim loại vào dung dịch muối của kim loại B
Để phản ứng xảy ra thì kim loại A phải hoạt động mạnh hơn kim loại B và đều không tác dụng với H2O ở điều kiện thường
Khi nhúng thanh kim loại A vào dd muối của kim loại B, nếu B bị đẩy hết và bám vào thanh kim loại A, khối lượng thanh kim loại A, khối lượng của thanh kim loại có thể tăng hoặc giảm.
- Nếu sau khi nhúng, đề bài cho khối lượng thanh kim loại tăng (hoặc khối lượng thanh kim loại B bám > khối lượng thanh kim loại A tan) thì:
Độ tăng khối lượng thanh = mkim loại B bám - mkim loại A tan
- Nếu sau khi nhúng, đề bài cho khối lượng thanh kim loại giảmg (hoặc khối lượng thanh kim loại B bám < khối lượng thanh kim loại A tan) thì:
Độ tăng khối lượng thanh = mkim loại A tan - mkim loại B bám
* Phương pháp giải:
- Gọi a là số mol kim loại A tham gia phản ứng
- Dựa vào đề bài, xác định độ tăng khối lượng của thanh kim loại
- Tìm a
* Với các dạng tăng giảm khối lượng khác có thể vận dụng định luật bảo toàn khối lượng.
II. Bài tập tăng giảm khối lượng lớp 9
* Bài tập 1: Ngâm một đinh sắt trong 100 ml dung dịch Cu(NO3)2 x M. Sau khi phản ứng kết thúc lấy đinh sắt ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tìm x?
* Lời giải:
Gọi a là số mol Cu(NO3)2 tham gia phản ứng
Phương trình hóa học:
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
a ← a → a a (mol)
Theo đề bài ta có:
mCu bám vào – mFe tan ra = mKL tăng
64a – 56a = 0,8 ⇔ a = 0,1
Nồng độ dung dịch Cu(NO3)2 là:
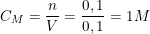
* Bài tập 2: Cho một miếng nhôm nặng 20 g vào 400 ml dd CuCl2 0,5M. Khi nồng độ dd CuCl2 gảm 25% thì lấy miếng nhôm ra rửa sạch, sấy khô cân nặng bao nhiêu g? Giả sử Cu bám hết vào miếng nhôm.
* Lời giải:
- Theo bài ra, ta có:
nCuCl2 = 0,4.0,5 = 0,2(mol)
- Ta có phương trình phản ứng:
2Al + 3CuCl2 → 2AlCl3 + 3Cu
Theo PTPƯ, ta có: nCuCl2(pư) = (25/100).0,2 = 0,05(mol)
Cứ 3 mol CuCl2 phản ứng thì khói lượng thanh Al tăng:
3.64 - 2.27 = 192 - 54 = 138(g)
suy ra: 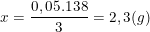
Khối lượng thanh nhôm sau phản ứng là: 20 + 2,3 = 22,3(g).
* Bài tập 3: Ngâm một lá kẽm có khối lượng 1 gam trong V (ml) dung dịch Cu(NO3)2 2M. Sau khi phản ứng kết thúc, lấy lá kẽm ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng lá kẽm giảm xuống 10% so với ban đầu. Tìm giá trị của V?
* Lời giải:
Ta có khối lượng lá Zn ban đầu bằng 1 gam
Gọi x là số mol Cu(NO3)2 tham gia phản ứng
Phương trình hóa học:
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
x ← x → x (mol)
Theo đề bài ta có:
mZn tan ra- mCu bám vào = mZnbđ.(10/100)
⇒ mZn tan ra- mCu bám vào = mZnbđ.(10/100)
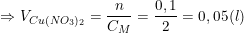
* Bài tập 4: Cho 5,6g sắt vào dung dịch đồng sunfat dư. Đến khi phản ứng xảy ra hoàn toàn, tính khối lượng đồng thu được?
* Bài tập 5: Nhúng một lá sắt vào dung dịch đồng sunfat sau một thời gian lấy lá sắt ra khỏi dung dịch cân lại thấy nặng hơn ban đầu 0,2g. Tìm khối lượng đồng bám vào lá sắt?
* Bài tập 6: Nhúng một thanh Zn vào dd chứa hỗn hợp 3,2 g CuSO4 và 6,24 g CdSO4. Hỏi sau khi Cu và Cd bị đẩy hoàn toàn khỏi dd thì khối lượng thanh Zn tăng hay giảm bao nhiêu?
* Bài tập 7: Ngâm một lá sắt trong 100ml dung dịch đồng nitrat cho đến khi sắt không thể tan thêm được nữa. Lấy lá sắt ra, rửa nhẹ, làm khô và cân thì khối lượng lá sắt tăng thêm 1,6g. Hãy xác định nồng độ mol của dung dịch đồng nitrat đã dùng (giả thiết toàn bộ đồng giải phóng ra bám hết vào lá sắt).
* Bài tập 8: Nhúng một miếng Al kim loại nặng 10 g vào 500 ml dd CuSO4 0,4M. Sau một thời gian lấy miếng Al ra, rửa sạch ,sấy khô cân nặng 11,38 g.
a) Tính khối lượng Cu thoát ra bám vào miếng Al.
b) Tính CM các chất sau phản ứng.
Đ/s: a) mCu = 1,92(g). b) CM(CuSO4) = 0,34M; CM(Al2(SO4)3) = 0,02M
Hy vọng với bài viết cách giải bài toán tăng giảm khối lượng lớp 9 môn Hóa học ở trên của Hay Học Hỏi giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để  ghi nhận và hỗ trợ, chúc các em học tốt.
ghi nhận và hỗ trợ, chúc các em học tốt.
Đánh giá & nhận xét


-
 Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
-
 Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 95 Chân trời sáng tạo SGK
Giải KHTN 9 trang 95 Chân trời sáng tạo SGK


















































