Bài tập luyên tập Phản ứng Oxi hóa khử - Hóa 10 bài 19
Phản ứng oxi hóa khử là một trong những phản ứng quan trọng trong hóa học vô cơ, vì vậy việc nắm vững khối kiến thức này giúp các dễ dàng lập các phương trình phản ứng qua đó giúp việc giải bài tập dễ dàng hơn.
Bài viết này nhằm củng cố kiến thức về sự oxi hóa, sự khử, chất oxi hóa, chất khử, phản ứng oxi hóa khử và phân loại phản ứng. Đồng thời, rèn luyện kỹ năng cân bằng phương trình hóa học của phản ứng oxi hóa khử bằng phương pháp thăng bằng electron.
A. Kiến thức cần nhớ
1. Sự oxi hóa, sự khử là gì?
- Sự oxi hoá là sự nhường electron, là sự tăng số oxi hoá.
- Sự khử là sự thu electron, là sự giảm số oxi hoá.
- Người ta còn gọi sự oxi hoá là quá trình oxi hoá, sự khử là quá trình khử.
2. Sự oxi hoá và sự khử là hai quá trình có bản chất trái ngược nhau nhưng xảy ra đồng thời trong một phản ứng. Đó là phản ứng oxi hoá - khử.
3. Chất khử, chất oxi hóa là gì?
- Chất khử là chất nhường electron, là chất chứa nguyên tố có số oxi hoá tăng sau phản ứng.
- Chất oxi hoá là chất thu electron, là chất chứa nguyên tố có số oxi hoá giảm sau phản ứng.
- Trong phản ứng oxi hoá - khử bao giờ cũng có chất khử và chất oxi hoá tham gia.
- Chất khử còn gọi là chất bị oxi hoá và chất oxi hoá còn gọi là chất bị khử.
4. Phản ứng oxi hóa - khử
- Phản ứng oxi hoá - khử là phản ứng hoá học trong đó có sự chuyển electron giữa các chất phản ứng. Nếu dựa vào sự thay đổi số oxi hoá thì phản ứng oxi hoá - khử là phản ứng hoá học trong đó có sự thay đổi số oxi hoá của một số nguyên tố.
5. Phân loại phản ứng hóa học
- Dựa vào số oxi hoá người ta chia các phản ứng thành 2 loại, đó là phản ứng oxi hoá - khử (số oxi hoá thay đổi) và phản ứng không thuộc loại phản ứng oxi hoá - khử (số oxi hoá không thay đổi).
B. Bài tập luyện tập phản ứng oxi hóa - khử
* Bài 1 trang 88 SGK Hóa 10: Loại phản ứng nào sau đây luôn luôn không là loại phản ứng oxi hóa – khử?
A. Phản ứng hóa hợp.
B. Phản ứng phân hủy.
C. Phản ứng thế trong hóa vô cơ
D. Phản ứng trao đổi.
* Lời giải:
- Đáp án đúng: D. Phản ứng trao đổi.
* Bài 2 trang 89 SGK Hóa 10: Loại phản ứng nào sau đây luôn luôn là phản ứng oxi hóa – khử?
A. Phản ứng hóa hợp.
B. Phản ứng phân hủy.
C. Phản ứng thế trong hóa vô cơ.
D. Phản ứng trao đổi.
* Lời giải:
- Đáp án đúng: C. Phản ứng thế trong hóa vô cơ.
* Bài 3 trang 89 SGK Hóa 10: Cho phản ứng: M2Ox + HNO3 → M(NO3)3 +...
Khi x có giá trị là bao nhiêu thì phản ứng trên không thuộc loại phản ứng oxi hóa – khử?
A. x = 1.
B. x = 2.
C. x= 1 hoặc x = 2.
D. x = 3.
Chọn đáp án đúng.
* Lời giải:
- Đáp án đúng: D. x = 3.
Vì x = 3 thì số oxi hóa của M trước và sau phản ứng không thay đổi vẫn là +3.
* Bài 4 trang 89 SGK Hóa 10: Câu nào đúng, câu nào sai trong các câu sau đây:
a) Sự oxi hóa một nguyên tố là lấy bớt electron của nguyên tố đó, là làm cho số oxi hóa của nguyên tố đó tăng lên.
b) Chất oxi hóa là chất thu electron, là chất chứa nguyên tố mà số oxi hóa của nó tăng sau phản ứng.
c) Sự khử một nguyên tố là sự thu thêm electron cho nguyên tố đó, làm cho số oxi hóa của nguyên tố đó giảm xuống.
d) Chất khử là chất thu electron, là chất chứa nguyên tố mà số oxi hóa của nó giảm sau phản ứng.
e) Tất cả đều sai.
* Lời giải:
- Câu sai: B, D, E.
- Câu đúng: A, C.
* Bài 5 trang 89 SGK Hóa 10: Hãy xác định số oxi hóa của các nguyên tố:
- Nitơ trong NO, NO2, N2O5, HNO3, HNO2, NH3, NH4Cl.
- Clo trong HCl, HClO, HClO2, HClO3, HClO4, CaOCl2.
- Mangan trong MnO2, KMnO4, K2MnO4, MnSO4.
- Crom trong K2Cr2O7, Cr2(SO4)3, Cr2O3.
- Lưu huỳnh trong H2S, SO2, H2SO3, H2SO4, FeS, FeS2.
* Lời giải:
• Đặt x là oxi hóa của nguyên tố N (nitơ) trong các hợp chất trên, ta có:
Trong NO: x + (-2) = 0 → x = +2.
Trong NO2: x + 2.(-2) = 0 → x = +4.
Trong N2O5: 2x + 5.(-2) = 0 → x = +5.
Trong HNO3: (+1) + x + 3.(-2) = 0 → x = +5.
Trong HNO2: (+1) + x +2.(-2) = 0 → x = +3.
Trong NH3 : x + 3.(+1) = 0 → x = -3.
Trong NH4Cl: x + 4.(+1) +(-1) = 0 → x = -3.
• Cũng giải tương tự như trên ta có:
Số oxi hóa của Cl trong: HCl, HClO, HClO2, HClO3, HClO4, CaOCl2.
lần lượt là: -1; +3; +5; +7; (-1 và + 1 trong CaOCl2)
• Số oxi hóa của Cr trong: K2Cr2O7, Cr2(SO4)3, Cr2O3.
lần lượt là: + 6; +3; +3.
• Số oxi hóa của S trong: H2S, SO2, H2SO3, H2SO4, FeS, FeS2.
Lần lượt là: -2; +4; +4; +6; -2; -1.
* Bài 6 trang 89 SGK Hóa 10: Cho biết đã xảy ra sự oxi hóa và sự khử những chất nào trong những phản ứng thế sau:
a) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
b) Fe + CuSO4 → FeSO4 + Cu.
c) 2Na + 2H2O → 2NaOH + H2.
* Lời giải:
Sự oxi hóa và sự khử xảy ra ở những chất trong phản ứng thế sau:
• Phản ứng: 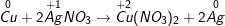
- Sự nhường electron của Cu được gọi là sự oxi hóa nguyên tử đồng:
Cu0 → Cu2+ + 2e
- Sự nhận electron của ion bạc được gọi là sự khử ion bạc:
Ag+ + 1e → Ag0
• Phản ứng: 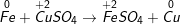
- Sự nhường electron của sắt được gọi là sự oxi hóa nguyên tử sắt:
Fe0 → Fe2+ + 2e
- Sự nhận electron của ion đồng được gọi là sự khử ion đồng:
Cu2+ + 2e → Cu0
• Phản ứng: 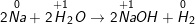
- Sự nhường electron của natri được gọi là sự oxi hóa nguyên tử natri:
Na0 → Na+ + e
- Sự nhận electron của ion hidro gọi là sự khử ion hiđro:
2H+ + 2e → H2
* Bài 7 trang 89 SGK Hóa 10: Dựa vào sự thay đổi số oxi hóa, tìm chất oxi hóa và chất khử trong những phản ứng sau:
a) 2H2 + O2 → 2H2O.
b) 2KNO3 → 2KNO2 + O2.
c) NH4NO2 → N2 + 2H2O.
d) Fe2O3 + 2Al → 2Fe + Al2O3.
* Lời giải:
Chất khử và chất oxi hóa trong các phản ứng sau là:
a) 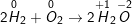
Chất khử : H2, chất oxi hóa O2
b) 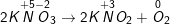
KNO3 vừa là chất oxi hóa, vừa là chất khử.
c) 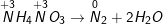
NH4NO2 vừa là chất oxi hóa, vừa là chất khử
d) 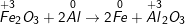
chất khử: Al, chất oxi hóa: Fe2O3
* Bài 8 trang 90 SGK Hóa 10: Dựa vào sự thay đổi số oxi hóa, hãy cho biết vai trò các chất tham gia trong các phản ứng oxi hóa – khử sau:
a) Cl2 + 2HBr → 2HCl + Br2.
b) Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O.
c) 2HNO3 + 3H2S → 3S + 2NO + 4H2O.
d) 2FeCl2 +Cl2 → 2FeCl3.
* Lời giải:
Vai trò các chất trong các phản ứng oxi hóa – khử sau là:
a) 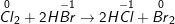
Chất khử Br-1 (trong HBr), chất oxi hóa Cl2
b) 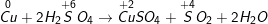
Chất khử Cu, chất oxi hóa S+6 (trong H2SO4)
c) 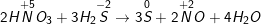
Chất khử S-2 (trong H2S), chất oxi hóa N+5 (trong HNO3)
d) 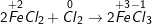
Chất khử Fe+2 (trong FeCl2), chất oxi hóa Cl20
* Bài 9 trang 90 SGK Hóa 10: Cân bằng các phương trình phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa ở mỗi phản ứng:
a) Al + Fe3O4 → Al2O3 + Fe
b) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
c) FeS2 + O2 → Fe2O3 + SO3
d) KClO3 → KCl + O2
e) Cl2 +KOH → KCl + KClO3 + H2O
* Lời giải:
> Lưu ý các bước để cân bằng phản ứng oxi hóa khử:
Bước 1: Xác định số oxi hóa của các chất trước và sau phản ứng, để tìm chất khử và chất oxi hóa
Bước 2: Viết quá trình oxi hóa khử, cân bằng mỗi quá trình
Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử, sao cho tổng số electron chất nhận = tổng số electron chất nhường
Bước 4: Đặt các hệ số của chất khử và chất oxi hóa vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
> Cân bằng các phương trình phản ứng oxi hóa – khử:
a) 8Al + 3Fe3O4 → 4Al2O3 + 9Fe
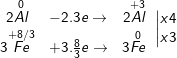
Chất khử Al; chất oxi hóa Fe3O4
b) 10FeSO4 + 2KМnО4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2
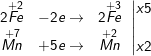
Chất khử là FeSO4; chât oxi hóa là KMnO4
c) 4FeS2 + 11O2 ⟶ 2Fe2O3 + 8SO2↑
Fe+2 - 1e → Fe+3
2S-1 - 2.5e → 2S+4
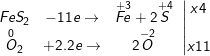
Chất khử FeS2; Chất oxi hóa O2
d) 2KClO3 ⟶ 2KCl + 3O2↑
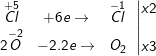
KClO3 vừa là chất oxi hóa, vừa là chất khử
e) 3Cl2 + 6KOH ![\small \xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2022_02/1645171196o8rzupdl5b.gif) 5KCl + KClO3 + 3H2O
5KCl + KClO3 + 3H2O
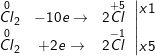
Cl2 vừa là chất oxi hóa, vừa là chất khử
* Bài 10 trang 90 SGK Hóa 10: Có thể điều chế MgCl2 bằng:
- Phản ứng hóa hợp.
- Phản ứng thế.
- Phản ứng trao đổi.
* Lời giải:
Điều chế MgCl2 bằng:
- Phản ứng hóa hợp: Mg + Cl2 → MgCl2
- Phản ứng thế: Mg + CuCl2 → MgCl2 + Cu
- Phản ứng trao đổi: Mg(OH)2 + 2HCl → MgCl2 + 2H2O
* Bài 11 trang 90 SGK Hóa 10: Cho những chất sau: CuO, dung dịch HCl, H2, MnO2.
a) Chọn từng cặp trong những chất đã cho để xảy ra phản ứng oxi hóa – khử và viết phương trình phản ứng.
b) Cho biết chất oxi hóa, chất khử, sự oxi hóa và sự khử trong những phản ứng hóa học nói trên.
* Lời giải:
a) Những cặp chất xảy ra phản ứng oxi hóa - khử
![\small \overset{+2}{Cu}O+\overset{0}{H}_2\xrightarrow[]{t^0}\overset{0}{Cu}+\overset{+1}{H}_2O](https://hayhochoi.vn/uploads/news/wyswyg/2022_02/1645171204bn6xakpzn4.gif) (1)
(1)
![\dpi{100} \fn_cm \small \overset{+4}{Mn}O_2+4H\overset{-1}{Cl}\xrightarrow[]{t^0}\overset{+2}{Mn}Cl_2+\overset{0}{Cl}_2 + 2H_2O](https://hayhochoi.vn/uploads/news/wyswyg/2022_02/16451712081howf816ru.gif) (2)
(2)
b) Cho biết chất oxi hóa, chất khử,...
Trong phản ứng (1):
- Nguyên tử hiđro nhường electron là chất khử, sự nhường electron của H2 được gọi là sự oxi hóa nguyên tử hiđro.
- Ion Cu nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Trong phản ứng (2):
- Ion Clo nhường electron là chất khử. Sự nhường electron của Cl được gọi là sự oxi hóa ion Clo.
- Ion Mn nhận electron là chất oxi hóa. Sự nhận electron của ion Mn được gọi là sự khử ion Mn.
* Bài 12 trang 90 SGK Hóa 10: Hòa tan 1,39g muối FeSO4.7H2O trong dung dịch H2SO4 loãng. Cho dung dịch này tác dụng với dung dịch KMnO4 0,1M. Tính thể tích dung dịch KMnO4 tham gia phản ứng.
* Lời giải:
- Theo bài ta, ta có: nFeSO4.7H2O = 1,337/278 = 0,005(mol) = nFeSO4
- Phương trình phản ứng hóa học.
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Theo PTPƯ ta có: nKMnO4 = (1/5).nFeSO4 = 0,005/5 = 0,001(mol)
Vậy thể tích dung dịch KMnO4 là:
V(dd KMnO4) = n/CM = 0,001/0,1 = 0,01(lít) = 10ml.
Hy vọng với bài viết Bài tập luyên tập Phản ứng Oxi hóa khử ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để hayhochoi ghi nhận và hỗ trợ, chúc các em học tốt.
Đánh giá & nhận xét
-
 Giải Hóa học 10 trang 20 - Kết nối tri thức
Giải Hóa học 10 trang 20 - Kết nối tri thức
-
 Giải Hóa học 10 trang 18 - Kết nối tri thức
Giải Hóa học 10 trang 18 - Kết nối tri thức
-
 Giải Hóa học 10 trang 17 - Kết nối tri thức
Giải Hóa học 10 trang 17 - Kết nối tri thức
-
 Giải Hóa học 10 trang 16 - Kết nối tri thức
Giải Hóa học 10 trang 16 - Kết nối tri thức
-
 Giải Hóa học 10 trang 15 - Kết nối tri thức
Giải Hóa học 10 trang 15 - Kết nối tri thức
-
 Giải Hóa học 10 trang 14 - Kết nối tri thức
Giải Hóa học 10 trang 14 - Kết nối tri thức
-
 Giải Hóa học 10 trang 13 - Kết nối tri thức
Giải Hóa học 10 trang 13 - Kết nối tri thức
-
 Giải Hóa học 10 trang 8 - Kết nối tri thức
Giải Hóa học 10 trang 8 - Kết nối tri thức
-
 Giải Hóa học 10 trang 7 - Kết nối tri thức
Giải Hóa học 10 trang 7 - Kết nối tri thức
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 4 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 4 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 3 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 3 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 2 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 2 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 1 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 1 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Phản ứng oxi hoá khử, cách lập phương trình hoá học và bài tập - hoá 10 bài 17
Phản ứng oxi hoá khử, cách lập phương trình hoá học và bài tập - hoá 10 bài 17
-
 Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
-
 Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Ôn tập chương 7: Nguyên tố nhóm Halogen? Hóa 10 bài 23 KNTT (Kết nối tri thức)
Ôn tập chương 7: Nguyên tố nhóm Halogen? Hóa 10 bài 23 KNTT (Kết nối tri thức)
-
 Tính chất hóa học của HydroHalic acid, muối Halide? Cấu tạo và tính chất vật lí của hydrogen Halide? Hóa 10 bài 22 KNTT
Tính chất hóa học của HydroHalic acid, muối Halide? Cấu tạo và tính chất vật lí của hydrogen Halide? Hóa 10 bài 22 KNTT
-
 Tính chất hóa học, tính chất vật lí của Halogen? Trạng thái tự nhiên, Cấu tạo nguyên tử Halogen? Hóa 10 bài 21 KNTT
Tính chất hóa học, tính chất vật lí của Halogen? Trạng thái tự nhiên, Cấu tạo nguyên tử Halogen? Hóa 10 bài 21 KNTT
-
 Ôn tập chương 6: Tốc độ phản ứng? Hóa 10 bài 20 KNTT (Kết nối tri thức)
Ôn tập chương 6: Tốc độ phản ứng? Hóa 10 bài 20 KNTT (Kết nối tri thức)
-
 Tốc độ phản ứng là gì? Các yếu tố ảnh hưởng tới tốc độ của phản ứng? Hóa 10 bài 19 KNTT
Tốc độ phản ứng là gì? Các yếu tố ảnh hưởng tới tốc độ của phản ứng? Hóa 10 bài 19 KNTT
-
 Ôn tập chương 5: Biến thiên Enthalpy trong các phản ứng hóa học? Hóa 10 bài 18 KNTT (Kết nối tri thức)
Ôn tập chương 5: Biến thiên Enthalpy trong các phản ứng hóa học? Hóa 10 bài 18 KNTT (Kết nối tri thức)


















































