Bài tập luyện tập Cấu tạo Vỏ nguyên tử - Hóa lớp 10
Ở nội dung các bài trước các em biết các electron chuyển động rất nhanh trong khu vực xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định tạo nên vỏ nguyên tử.
Bài học này chúng ta sẽ giải một số bài tập về cấu tạo vỏ nguyên tử qua đó rèn luyện kỹ năng xác định số electron của các lớp và số electron lớp ngoài cùng. Đồng thời củng cố kiến thức về phân lớp electron theo chiều tăng của năng lượng trong nguyên tử; Số electron tối đa trong một phân lớp, một lớp và cấu hình electron của nguyên tử.
I. Cấu tạo vỏ nguyên tử - kiến thức cần nhớ
1. Lớp và phân lớp electron
• Số electron tối đa ở lớp thứ n (1, 2, 3, 4) là: 2n2
• Số electron tối đa ở mỗi phân lớp là: s2; p6; d10; f14.
| Số thứ tự lớp (nn) | 1 | 2 | 3 | 4 |
| Tên của lớp | K | L | M | N |
| Số electron tối đa | 2 | 8 | 18 | 32 |
| Số phân lớp | 1 | 2 | 3 | 4 |
| Kí hiệu phân lớp | 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
| Số electron tối đa ở phân lớp và ở lớp | 2 | (2,6)→8 | (2,6,10)→18 | (2,6,10,14)→32 |
2. Mối liên hệ giữa lớp electron ngoài cùng với loại nguyên tố
- Lớp electron ngoài cùng quyết định tính chất hóa học của nguyên tố, sẽ bão hòa bền với 8e (trừ heli (He) có 2e ngoài cùng).
| Cấu hình electron lớp ngoài cùng |
ns1 ns2 ns2np1 |
ns2np2 |
ns2np3 ns2np4 ns2np5 |
ns2np6 (He:1s2) |
| Số electron thuộc lớp ngoài cùng | 1, 2 hoặc 3 | 4 | 5, 6 hoặc 7 | 8 (2 ở He) |
| Loại nguyên tố |
Kim loại (trừ H, He, B) |
Có thể là kim loại hoặc phi kim | Thường là phi kim | Khí hiếm |
| Tính chất cơ bản của nguyên tố | Tính kim loại | Có thể là tính kim loại hay tính phi kim | Thường có tính phi kim | Tương đối trơ về mặt hóa học |
II. Bài tập về Cấu tạo vỏ nguyên tử
* Bài 1 trang 30 SGK Hóa 10: Thế nào là nguyên tố s, p, d, f?
* Lời giải Bài 1 trang 30 SGK Hóa 10:
- Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
- Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
- Nguyên tố d là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
- Nguyên tố f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
* Bài 2 trang 30 SGK Hóa 10: Các electron thuộc lớp K hay lớp L liên kết với hạt nhân chặt chẽ hơn? Vì sao?
* Lời giải Bài 2 trang 30 SGK Hóa 10:
- Các electron thuộc lớp K liên kết với hạt nhân chặt chẽ hơn lớp L vì gần hạt nhân hơn và mức năng lượng thấp hơn.
* Bài 3 trang 30 SGK Hóa 10: Trong nguyên tử, những electron của lớp nào quyết định tính chất hóa học của nguyên tử nguyên tố đó? Cho thí dụ.
* Lời giải Bài 3 trang 30 SGK Hóa 10:
- Trong nguyên tử, các electron ở lớp ngoài cùng quyết định tính chất hóa học của nguyên tử nguyên tố.
- Ví dụ: Liti (Li), Natri (Na) có 1e ở lớp ngoài cùng nên thể hiện tính chất của kim loại; Oxi (O) và Lưu huỳnh (S) đều có 6e ở lớp ngoài cùng nên thể hiện tính chất của phi kim.
* Bài 4 trang 30 SGK Hóa 10: Vỏ electron của một nguyên tử có 20 electron. Hỏi:
a) Nguyên tử đó có bao nhiêu lớp electron?
b) Lớp ngoài cùng có bao nhiêu electron?
c) Đó là nguyên tố kim loại hay phi kim?
* Lời giải Bài 4 trang 30 SGK Hóa 10:
- Nguyên tử có 20 electron nghĩa là có 20 proton hay số đơn vị điện tích hạt nhân là 20.
- Cấu hình electron: 1s22s22p63s23p64s2.
a) Nguyên tử có 4 lớp electron
b) Lớp ngoài cùng có 2 electron
c) Đó là kim loại.
* Bài 5 trang 30 SGK Hóa 10: Cho biết số electron tối đa ở các phân lớp sau:
a) 2s. b) 3p. c) 4s. d) 3d.
* Lời giải Bài 5 trang 30 SGK Hóa 10:
a) 2s2. b) 3p6. c) 4s2. d) 3d10.
a) Nguyên tử photpho có bao nhiêu electron?
b) Số hiệu nguyên tử của P là bao nhiêu?
c) Lớp electron nào có mức năng lượng cao nhất?
d) Có bao nhiêu lớp, mỗi lớp có bao nhiêu electron?
e) Photpho là nguyên tố kim loại hay phi kim? Cho thí dụ.
* Lời giải Bài 6 trang 30 SGK Hóa 10:
a) Nguyên tử photpho có: 15e
b) Số hiệu nguyên tử của P là: 15
c) Lớp thứ 3 có mức năng lượng cao nhất.
d) Có 3 lớp electron:
Lớp thứ nhất có: 2e
Lớp thứ hai có: 8e
Lớp thứ ba có: 5e
e) P là phim kim vì có 5e ở lớp ngoài cùng.
* Bài 7 trang 30 SGK Hóa 10: Cấu hình electron của nguyên tử cho ta những thông tin gì? Cho thí dụ.
* Lời giải Bài 7 trang 30 SGK Hóa 10:
- Cấu hình electron của nguyên tử cho ta biết: Sự phân bố electron trên các lớp và phân lớp. Từ đó dự đoán được nhiều tính chất của nguyên tử nguyên tố.
- Ví dụ: Nguyên tử K có cấu hình electron là 1s22s22p63s23p64s1
Nguyên tử K thuộc nhóm IA là kim loại hoạt động mạnh có 1e lớp ngoài cùng, có 4 lớp electron.
* Bài 8 trang 30 SGK Hóa 10: Viết cấu hình electron đầy đủ cho các nguyên tử có lớp electron ngoài cùng là:
a) 2s1. b) 2s22p3. c) 2s22p6.
d) 3s23p3. e) 3s23p5. g) 3s23p6.
* Lời giải Bài 8 trang 30 SGK Hóa 10:
- Cấu hình electron đầy đủ cho các nguyên tử:
a) 1s22s1. b) 1s22s22p3.
c) 1s22s22p6. d) 1s22s22p63s23p3.
e) 1s22s22p63s23p5. g) 1s22s22p63s23p6
* Bài 9 trang 30 SGK Hóa 10: Cho biết tên, kí hiệu, số hiệu nguyên tử của:
a) 2 nguyên tố có số electron lớp ngoài cùng tối đa.
b) 2 nguyên tố có 1 electron ở lớp ngoài cùng.
c) 2 nguyên tố có 7 electron ở lớp ngoài cùng.
* Lời giải Bài 9 trang 30 SGK Hóa 10:
a) 2 nguyên tố có tối đa 8 electron ở lớp ngoài cùng là:
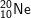 : 1s22s22p6 ⇒ có 8e lớp ngoài cùng
: 1s22s22p6 ⇒ có 8e lớp ngoài cùng
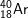 : 1s22s22p63s23p6 ⇒ có 8e lớp ngoài cùng
: 1s22s22p63s23p6 ⇒ có 8e lớp ngoài cùng
b) 2 nguyên tố có 1 electron ở lớp ngoài cùng là:
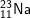 : 1s22s22p63s1 ⇒ có 1 e lớp ngoài cùng
: 1s22s22p63s1 ⇒ có 1 e lớp ngoài cùng
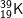 : 1s22s22p63s23p64s1 ⇒ có 1 e lớp ngoài cùng
: 1s22s22p63s23p64s1 ⇒ có 1 e lớp ngoài cùng
c) 2 nguyên tố có 7 electron ở lớp ngoài cùng là:
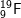 : 1s22s22p5 ⇒ có 7e lớp ngoài cùng
: 1s22s22p5 ⇒ có 7e lớp ngoài cùng
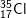 : 1s22s22p63s23p5 ⇒ có 7e lớp ngoài cùng
: 1s22s22p63s23p5 ⇒ có 7e lớp ngoài cùng
Như vậy, với bài viết củng cố lại kiến thức và một số bài tập về cấu tạo vỏ nguyên tử ở trên các em cần ghi nhớ về lớp và phân lớp electron và mối liên hệ giữa electron lớp ngoài cùng với loại nguyên tố. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để hayhochoi.vn ghi nhận và hỗ trợ, chúc các em học tốt.
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét
-
 Giải Hóa học 10 trang 20 - Kết nối tri thức
Giải Hóa học 10 trang 20 - Kết nối tri thức
-
 Giải Hóa học 10 trang 18 - Kết nối tri thức
Giải Hóa học 10 trang 18 - Kết nối tri thức
-
 Giải Hóa học 10 trang 17 - Kết nối tri thức
Giải Hóa học 10 trang 17 - Kết nối tri thức
-
 Giải Hóa học 10 trang 16 - Kết nối tri thức
Giải Hóa học 10 trang 16 - Kết nối tri thức
-
 Giải Hóa học 10 trang 15 - Kết nối tri thức
Giải Hóa học 10 trang 15 - Kết nối tri thức
-
 Giải Hóa học 10 trang 14 - Kết nối tri thức
Giải Hóa học 10 trang 14 - Kết nối tri thức
-
 Giải Hóa học 10 trang 13 - Kết nối tri thức
Giải Hóa học 10 trang 13 - Kết nối tri thức
-
 Giải Hóa học 10 trang 8 - Kết nối tri thức
Giải Hóa học 10 trang 8 - Kết nối tri thức
-
 Giải Hóa học 10 trang 7 - Kết nối tri thức
Giải Hóa học 10 trang 7 - Kết nối tri thức
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 4 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 4 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 3 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 3 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 2 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 2 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 1 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 1 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Phản ứng oxi hoá khử, cách lập phương trình hoá học và bài tập - hoá 10 bài 17
Phản ứng oxi hoá khử, cách lập phương trình hoá học và bài tập - hoá 10 bài 17
-
 Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
-
 Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Ôn tập chương 7: Nguyên tố nhóm Halogen? Hóa 10 bài 23 KNTT (Kết nối tri thức)
Ôn tập chương 7: Nguyên tố nhóm Halogen? Hóa 10 bài 23 KNTT (Kết nối tri thức)
-
 Tính chất hóa học của HydroHalic acid, muối Halide? Cấu tạo và tính chất vật lí của hydrogen Halide? Hóa 10 bài 22 KNTT
Tính chất hóa học của HydroHalic acid, muối Halide? Cấu tạo và tính chất vật lí của hydrogen Halide? Hóa 10 bài 22 KNTT
-
 Tính chất hóa học, tính chất vật lí của Halogen? Trạng thái tự nhiên, Cấu tạo nguyên tử Halogen? Hóa 10 bài 21 KNTT
Tính chất hóa học, tính chất vật lí của Halogen? Trạng thái tự nhiên, Cấu tạo nguyên tử Halogen? Hóa 10 bài 21 KNTT
-
 Ôn tập chương 6: Tốc độ phản ứng? Hóa 10 bài 20 KNTT (Kết nối tri thức)
Ôn tập chương 6: Tốc độ phản ứng? Hóa 10 bài 20 KNTT (Kết nối tri thức)
-
 Tốc độ phản ứng là gì? Các yếu tố ảnh hưởng tới tốc độ của phản ứng? Hóa 10 bài 19 KNTT
Tốc độ phản ứng là gì? Các yếu tố ảnh hưởng tới tốc độ của phản ứng? Hóa 10 bài 19 KNTT
-
 Ôn tập chương 5: Biến thiên Enthalpy trong các phản ứng hóa học? Hóa 10 bài 18 KNTT (Kết nối tri thức)
Ôn tập chương 5: Biến thiên Enthalpy trong các phản ứng hóa học? Hóa 10 bài 18 KNTT (Kết nối tri thức)


















































