Tính chất hóa học của kim loại, ví dụ và bài tập - Hóa lớp 9 bài 16
Kim loại có những tính chất vật lý và hóa học gì mà lại được ứng dụng rất nhiều trong thực tế từ những vật nhỏ như cái kim hay lớn như máy bay, tàu ngầm,...
Chúng ta hãy cùng tìm hiểu những tính chất hóa học của Kim loại trong bài viết này. Qua đó giúp các em nắm vững những kiến thức nền tảng thật tốt để ôn và thi bậc THPT sau này.
* Tính chất hóa học của kim loại:
- Tác dụng với Oxi
- Tác dụng với phi kim khác
- Tác dụng với Axit
- Tác dụng với Muối
Chi tiết các phương trình phản ứng, ví dụ và bài tập chúng ta cùng tìm hiểu dưới đây;
I. Tính chất hóa học của kim loại
1. Tác dụng với oxi
- Kim loại (trừ Au, Ag, Pt) tác dụng với oxi tạo oxit kim loại.
PTPƯ: Kim loại + O2 → Oxit kim loại
2Mg + O2 → 2MgO
2Al + 3O2 → 2Al2O3
3Fe + 2O2 → Fe3O4
2. Tác dụng với phi kim khác
+ Tác dụng với Cl2: tạo muối clorua (kim loại có hóa trị cao nhất)
PTPƯ: Kim loại + Cl2 → Muối
Cu + Cl2 → CuCl2
2Al + 3Cl2 → 2AlCl3
2Fe + 3Cl2 → 2FeCl3
- Nếu Fe dư: Fedư + FeCl3 → FeCl2
+ Tác dụng với lưu huỳnh: khi đun nóng tạo muối sunfua (trừ Hg xảy ra ở nhiệt độ thường)
Cu + S 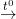 CuS
CuS
Fe + S 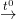 FeS
FeS
Hg + S → HgS
- Lưu ý: Thủy ngân khá độc, không nên tiếp xúc trực tiếp với thủy ngân.
3. Tác dụng với Axit
+ Với dụng dịch axit HCl, H2SO4 loãng
PTPƯ: Kim loại + Axit(dd loãng) → Muối + H2↑
Fe + HCl → FeCl2 + H2↑
Zn + H2SO4 loãng → ZnSO4 + H2↑
+ Với axit H2SO4 đặc
2Ag + H2SO4 đặc, nóng→ Ag2SO4 + SO2↑ + 2H2O
2Al + 6H2SO4 đặc, nóng → Al2(SO4)3 + 3SO2↑ + 6H2O
4. Tác dụng với dung dịch muối
- Kim loại mạnh đẩy kim loại yếu hơn ra khỏi muối, tạo thành muối mới và kim loại mới.
PTPƯ: Kim loại + Muối → Muối(mới) + Kim loại↓(mới)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag

Nhận xét: Cu hoạt động hóa học mạnh hơn Ag
Fe + CuSO4 → FeSO4 + Cu
Nhận xét: Fe hoạt động hóa học mạnh hơn Cu
Dãy điện hoá kim loại:
K > Na > Ca > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Pt > Au
Cách nhớ: Khi Nào Cần Mua Áo Záp Sắt Nhìn Sang Phải Hỏi Cửa Hàng Á Pi Âu
|
>> có thể bạn muốn xem: |
II. Bài tập về tính chất hóa học của Kim loại
* Bài tập 1 trang 51 sgk hóa 9: Kim loại có những tính chất hóa học nào? Lấy ví dụ và viết các phương trình hóa học minh họa với kim loại magie.
>> Giải bài tập 1 trang 51 sgk hóa 9
* Bài tập 2 trang 51 sgk hóa 9: Hãy hoàn thành các phương trình hóa học sau đây:
a) ... + HCl → MgCl2 + H2
b) ... + AgNO3 → Cu(NO3)2 + Ag
c) ... + ... → ZnO
d) ... + Cl2 → HgCl2
e) ... + S → K2S.
>> Giải bài tập 2 trang 51 sgk hóa 9
* Bài tập 3 trang 51 sgk hóa 9: Viết các phương trình hóa học xảy ra giữa các cặp chất sau đây:
a) Kẽm + axit sunfuric loãng.
b) Kẽm + dung dịch bạc nitrat.
c) Natri + lưu huỳnh.
d) Canxi + clo.
>> Giải bài tập 3 trang 51 sgk hóa 9
* Bài tập 4 trang 51 sgk hóa 9: Dựa vào tính chất hóa học của kim loại, hãy viết các phương trình hóa học biểu diễn các chuyển hóa sau đây:
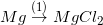 ;
; 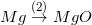 ;
; 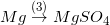 ;
;
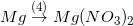 ;
; 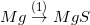
>> Giải bài tập 4 trang 51 sgk hóa 9
* Bài tập 5 trang 51 sgk hóa 9: Dự đoán hiện tượng và viết phương trình hóa học xảy ra, khi:
a) Đốt dây sắt trong khí clo.
b) Cho một đinh sắt vào trong ống nghiệm đựng dung dịch CuCl2.
c) Cho một viên kẽm vào dung dịch CuSO4.
>> Giải bài tập 5 trang 51 sgk hóa 9
* Bài tập 6 trang 51 sgk hóa 9: Ngâm một lá kẽm trong 20g dung dịch muối đồng sunfat 10% cho đến khi phản ứng kết thúc. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
>> Giải bài tập 6 trang 51 sgk hóa 9
* Bài tập 7 trang 51 sgk hóa 9: Ngâm một lá đồng trong 20 ml dung dịch bạc nitrat cho tới khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhẹ, làm khô và cân thì thấy khối lượng lá đồng tăng thêm 1,52 g. Hãy xác định nổng độ mol của dung dịch bạc nitrat đã dùng (giả thiết toàn bộ lượng bạc giải phóng bám hết vào lá đồng).
>> Giải bài tập 7 trang 51 sgk hóa 9
* Bài tập 6 trang 58 sgk hóa 9: Để xác định phần trăm khối lượng của hỗn hợp A gồm nhôm và magie, người ta thực hiện hai thí nghiệm sau:
– Thí nghiệm 1: Cho m gam hỗn hợp A tác dụng với dung dịch H2SO4 loãng dư, thu được 1568ml khí ở điều kiện tiêu chuẩn.
– Thí nghiệm 2: Cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư thì sau phản ứng thấy còn lại 0,6g chất rắn.
Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.
* Lời giải bài tập 6 trang 58 sgk hóa 9:
- Ở thí nghiệm 2: Do NaOH dư nên Al sẽ tác dụng hết với NaOH, còn Mg không phản ứng nên khối lượng chất rắn còn lại là Mg, mMg = 0,6g.
⇒ nMg = 0,6/24 = 0,025 mol
Ta gọi số mol của Al là x(tức nAl = x); PTPƯ
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑ ( 1)
Mg + H2SO4 → MgSO4 + H2↑ (2)
- Theo PTPƯ (2) nH2 = nMg = 0,025 mol
- Theo PTPƯ (1) nH2 = (3/2). nAl = (3/2). x mol
⇒ Tổng số mol H2 là nH2 = 0,025 + 3x/2 mol (∗)
- Theo đề bài ta có: VH2 = 1568ml = 1,568 (l).
⇒ nH2 = 1,568/22,4 = 0,07 mol (∗∗)
- Từ (∗) và (∗∗) ⇒ 0,025 + 3x/2 = 0,07
- Giải ra ta có : x = 0,03 mol ⇒ mAl = 0,03 x 27 = 0,81g
⇒ mhỗn hợp A = 0,81 + 0,6 = 1,41 g
⇒ % mAl = (0,81 x 100%)/1,41 = 57,45%
⇒ % mMg = 100% - 57,45% = 42,55%.
* Bài tập 5 trang 60 sgk hóa 9: Ngâm bột sắt dư trong 10ml dung dịch đồng sunfat 1M. Sau khi phản ứng kết thúc, lọc được chất rắn A và dung dịch B.
a) Cho A tác dụng với dung dịch HCl dư. Tính khối lượng chất rắn còn lại sau phản ứng.
b) Tính thể tích dung dịch NaOH 1M vừa đủ để kết tủa hoàn toàn dung dịch B.
* Lời giải bài tập 5 trang 60 sgk hóa 9:
a) Ta có PTPƯ: Fe + CuSO4 → FeSO4 + Cu (1)
Do Fe dư, nên chất rắn A gồm sắt dư và đồng, dung dịch B là FeSO4.
- Theo bài ra: nCuSO4 = CM .V = 1. 0,01 = 0,01 (mol)
- Theo PTPƯ: nCu = nCuSO4 = 0,01 mol
- Khi cho A tác dụng với dung dịch HCl chỉ có Fe phản ứng (Cu không phản ứng) nên ta có PTPƯ sau:
Fe + 2HCl → FeCl2 + H2↑ (2)
- Khối lượng chất rắn còn lại sau phản ứng với HCl chỉ có Cu
⇒ mCu = 0,01 x 64 = 0,64g.
b) Dung dịch B chỉ có FeSO4:
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4 (3)
Theo PTPƯ (1) thì nFeSO4 = nCuSO4 = 0,01 mol
Theo PTPƯ (3) thì nNaOH = 2.nFeSO4 = 2.0,01 = 0,02 mol
⇒ VNaOH = n/CM = 0,02/1 = 0,02 lít.
* Bài 6 trang 69 sgk hóa 9: Ngâm một lá sắt có khối lượng 2,5 gam trong 25 ml dung dịch CuSO4 15% có khối lượng riêng là 1,12 g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô thì cân nặng 2,58 gam.
a) Hãy viết phương trình hoá học.
b) Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
* Lời giải bài 6 trang 69 sgk hóa 9:
a) Phương trình hoá học:
Fe + CuSO4 → FeSO4 + Cu↓
1 mol 1 mol 1 mol 1 mol
b) Theo PTPƯ cứ 1 mol Fe phản ứng tạo thành 1 mol Cu thì khối lượng thanh Fe tăng thêm là : 64 – 56 = 8 (g)
- Gọi số mol Fe tham gia phản ứng là x
- Theo bài ra số gam tăng lên sau khi lấy lá thép ra là: 2,58 – 2,5 = 0,08 (g)
⇒ x = (0,08.1)/8 = 0,01 (mol).
⇒ nFeSO4 = 0,01 mol ⇒ mFeSO4 = 0,01.152 = 1,52 (g).
⇒ mdd CuSO4 = D . V = 1,12.25 = 28 (g).
⇒ mCuSO4 = mdd.C% = 28.(15/100) = 4,2 (g)
⇒ nCuSO4 = 4,2/160 = 0,02625 (mol)
⇒ CuSO4 dư và nCuSO4 dư = 0,02625 – 0,01 = 0,01625 (mol)
- Chất sau phản ứng là: FeSO4 và CuSO4 dư
⇒ mCuSO4 dư = 0,01625.160 = 2,6 (g).
⇒ mdd sau pư = 28 +2,5 – 2,58 = 27,92 (g).
⇒ C% FeSO4 = (1,52/27,92). 100 = 5,4441 (%)
⇒ C% CuSO4 dư = (2,6/27,92). 100 = 9,3123 (%)
* Bài tập 7 trang 69 sgk hóa 9: Cho 0,83g hỗn hợp gồm nhôm và sắt tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng thu được 0,56 lít khí ở đktc.
a) Viết các phương trình hóa học.
b) Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
* Lời giải bài tập 7 trang 69 sgk hóa 9:
a) PTPƯ:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑ (1)
Fe + H2SO4 → FeSO4 + H2↑ (2)
b) Khí thu được là Hyđro, theo bài ra ta có:
nH2 = 0,56 /22,4 = 0,025 mol.
Gọi số mol của Al và Fe lần lượt là x và y
Theo PTPƯ (1) thì nH2 = (3/2). nAl = (3/2). x mol
Theo PTPƯ (2) nH2 = nFe = y mol
Như vậy ta có: nH2 = 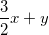 = 0,025 mol. (*)
= 0,025 mol. (*)
Theo bài ra, ta có: mhh = 27x + 56y = 0,83. (**)
Giải hệ phương trình (*) và (**) ta được: x =0,01; y= 0,01
⇒ mAl = 0,01 x 27 = 0,27g
⇒ mFe = 0,01 x 56 = 0,56g
Vậy %mAl = 0,27/0,83 x 100% = 32,53% ⇒ %mFe = 67,47%
* Bài tập 1: Cho 5,60 gam Fe tác dụng với dung dịch HCl vừa đủ thu được dung dịch X. Cho dung dịch X tác dụng với dung dịch AgNO3 thì thu được m gam kết tủa. Biết các phản ứng là hoàn toàn, giá trị của m là
* Hướng dẫn giải: Ta có PTPƯ
Fe+ 2HCl → FeCl2 + H2↑
FeCl2 + 3AgNO3 → 2AgCl + Ag↓ + Fe(NO3)3
Theo bài có: nFe = m/M =5,6/56=0,1 (mol)
Theo PTPƯ ⇒ nAg = nFe = 0,1 mol; nAgCl = 2nFe = 2.0,1=0,2 (mol)
⇒ m↓ = mAg + mAgCl = 0,1.108 + 0,2.143,5 = 39,5 (g)
* Bài tập 2: Cho 8 gam hỗn hợp X gồm Mg và Cu tác dụng với dung dịch H2SO4 loãng dư. Đến khi kết thúc phản ứng thu được 4,48 lít khí H (đktc). Phần trăm khối lượng của Mg trong X là:
* Hướng dẫn giải: Chỉ có Mg phản ứng với H2SO4 (loãng)
Mg+ H2SO4 → MgSO4 + H2↑
Theo PTPƯ ta có: nMg = nH2 = 4,48/22,4=0,2 (mol)
⇒ mMg = 0,2.24=4,8
⇒ %Mg = (4,8/8).100%=60%
Hy vọng với phần ôn tập về tính chất hóa học của kim loại, kim loại kiềm, kiềm thổ với các ví dụ và bài tập vận dụng ở trên hữu ích với các bạn. Mọi thắc mắc các bạn hãy để lại bình luận dưới bài viết để được hayhochoi.vn ghi nhận và hỗ trợ, chúc các bạn học tập tốt.
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét


















-
 Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
Tính chất hoá học của Oxide, Acid, Base và Muối - Hoá lớp 9
-
 Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 95 Chân trời sáng tạo SGK
Giải KHTN 9 trang 95 Chân trời sáng tạo SGK


















































