Các dạng bài tập về muối Cacbonat và cách giải - Hóa 12 chuyên đề
Bài tập về muối cacbonat trong hóa học 12 là một trong những dạng mà chúng ta cũng hay gặp trong các bài thi tốt nghiệp THPT.
Liên quan tới bài tập về muối cacbonat có 2 dạng phổ biến mà chúng ta thường gặp là phản ứng nhiệt phân muối cacbonat và phản ứng trao đổi của muối cácbonat (với axit và một số muối kết tủa). Trong bài viết này, chúng ta cùng tìm hiểu cách giải một số bài tập về muối cacbonat.
I. Phương pháp giải bài tập muối cacbonat
1. Phản ứng nhiệt phân của muối cácbonat
• Muối Hidrocacbonat cho muối cacbonat:
2MHCO3 ![\small \xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2022_01/giflatexsmallspacexrightarrow_1642394145.gif) M2CO3 + CO2↑ + H2O
M2CO3 + CO2↑ + H2O
M(HCO3)2 ![\small \xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2022_01/giflatexsmallspacexrightarrow_1642394145.gif) MCO3 + CO2↑ + H2O
MCO3 + CO2↑ + H2O
• Muối cacbonat của kim loại kiềm thổ chỉ bị nhiệt phân ở nhiệt độ cao cho oxit bazơ:
MCO3 ![\small \xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2022_01/giflatexsmallspacexrightarrow_1642394145.gif) MO + CO2↑
MO + CO2↑
2. Phản ứng trao đổi (với axit tạo khí CO2, với một số muối tạo kết tủa)
• Để giải dạng bài tập này thường sử dụng: Định luật bảo toàn khối lượng và Định luật tăng giảm khối lượng.
* Một số lưu ý:
+ Khi cho từ từ dd HCl vào hỗn hợp muối cacbonat và hidrocacbonat, phản ứng xảy ra theo trình tự:
Đầu tiên: H+ + CO32- → HCO3-
Sau đó: HCO3- + H+ → CO2 + H2O
+ Khi cho từ từ dung dịch muối cacbonat (hoặc hỗn hợp muối cacbonat và hiđrocacbonat) vào dung dịch axit thì phản ứng xảy ra đồng thời như sau:
CO32- + 2H+ → CO2↑ + H2O
HCO3- + H+ → CO2↑ + H2O
+ Khi cho muối hidrocacbonat tác dụng với dung dịch bazo sẽ tạo ra muối cacbonat
HCO3- + OH- → CO32- + H2O
II. Bài tập về muối cacbonat
* Bài tập 1: Khi nung 30 gam hỗn hợp CaCO3 và MgCO3 thì khối lượng chất rắn thu được sau phản ứng chỉ bằng một nửa khối lượng ban đầu. Tính thành phần % theo khối lượng các chất ban đầu?
> Lời giải:
- Gọi x, y lần lượt là số mol CaCO3 và MgCO3 trong hỗn hợp
- Ta có phương trình phản ứng (phản ứng nhiệt phân):
CaCO3 ![\small \xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2022_01/giflatexsmallspacexrightarrow_1642394145.gif) CaO + CO2↑
CaO + CO2↑
x(mol) x x
MgCO3 ![\small \xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2022_01/giflatexsmallspacexrightarrow_1642394145.gif) MgO + CO2↑
MgO + CO2↑
y(mol) y y
Sau phản ứng nhiệt phân, chất rắn còn lại là CaO và MgO
Vậy bài ra, khối lượng chất rắn thu được (CaO, MgO) bằng một nửa khối lượng chất rắn ban đầu (CaCO3, MgCO3) nên ta có phương trình:
56x + 40y = (100x + 4y)/2 ⇒ x/y = 1/3 hay y = 3x.
Vậy ta có phần trăm khối lượng các chất ban đầu là:
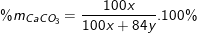
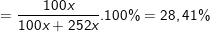
⇒ %mMgCO3 = 100% - 28,41% = 71,59%
* Bài tập 2: Khi nung nóng 48,8gam hỗn hợp A gồm 3 muối NH4HCO3, NaHCO3 và Ca(HCO3)2 đến khối lượng không đổi thu được 16,2 chất rắn X. Cho X tác dụng với dung dịch axít HCl thu được 2,24 lít (đktc) khí. Xác định khối lượng của mỗi muối trong hỗn hợp A.
> Lời giải:
- Gọi x, y, z lần lượt là số mol của NH4HCO3, NaHCO3 và Ca(HCO3)2
- Theo bài ra, ta có : 79x + 84y + 162z = 48,8 (*)
Khi nung nóng A xảy ra các phản ứng nhiệt phân:
NH4HCO3 ![\small \xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2022_01/1642394172nkx4ut9jhj.gif) NH3 + CO2↑ + H2O (1)
NH3 + CO2↑ + H2O (1)
2NaHCO3 ![\small \xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2022_01/1642394172nkx4ut9jhj.gif) Na2CO3 + CO2↑ + H2O (2)
Na2CO3 + CO2↑ + H2O (2)
y y/2
Ca(HCO3)2 ![\small \xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2022_01/1642394172nkx4ut9jhj.gif) CaO + 2CO2↑+ H2O (3)
CaO + 2CO2↑+ H2O (3)
z z
- Chất rắn Y gồm: Na2CO3, CaO nên theo bài ra và phương trình hóa học (2),(3) trên ta có:
(106y)/2 + 56z = 16,2 (**)
- Chất rắn Y tác dụng với HCl:
Phương trình phản ứng:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O (4)
y(mol) y
CaO + 2HCl → CaCl2 + H2O (5)
Theo phương trình phản ứng (4) và theo bài ra, ta có số mol CO2 thu được:
y = nCO2 = 2,24/22,4 = 0,1 mol (***)
Từ (*), (**) và (***) ta có : x = 0,11; y = 0,1 và z = 0,19
Khối lượng mỗi muối trong hỗn hợp A là:
mNH4HCO3 = 0,11.79 = 8,69 (g)
mNaHCO3 = 0,1.162 = 16,2 (g)
mCaO = 0,19.56 = 10,64 (g).
* Bài tập 3: Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Tìm giá trị của V?
> Lời giải:
- Theo bài ta, ta có: nHCl = 0,2.1 = 0,2 mol;
nNa2CO3 = 1,5.0,1 = 0,15 mol;
nKHCO3 = 1.0,1 = 0,1 mol;
Phương trình hóa học:
CO32- + H+ → HCO3- (1)
0,15(mol) 0,15
HCO3- + H+ → CO2↑ + H2O (2)
0,05(mol)
Sau phản ứng (1) số mol HCl còn là: 0,2 - 0,15 = 0,05 (mol)
nên ở phản ứng (2) tính số mol theo H+ (do HCO3- dư)
Vậy thể tích khí CO2 thoát ra là: V = 0,05.22,4 = 1,12 lít.
* Bài tập 4: Cho 2,84 g hỗn hợp CaCO3 và MgCO3 tác dụng hết với dung dịch HCl thấy bay ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của hai muối (CaCO3 và MgCO3) trong hỗn hợp là bao nhiêu?
> Lời giải:
- Theo bài ra, số mol CO2 (672ml = 0,672l) là:
nCO2 = 0,672/22,4 = 0,03 mol.
- Gọi x, y lần lượt là số mol CaCO3 và MgCO3 trong hỗn hợp
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
x x
MgCO3 + 2HCl → MgCl2 + CO2↑ + H2O
y y
- Theo PTPƯ và bài ra, ta có hệ phương trình:
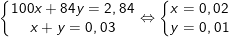
Vậy phần trăm khối lượng của các muối trong hỗn hợp là:
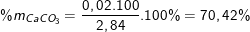
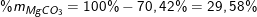
* Bài tập 5: Hấp thụ hoàn toàn 0,672lit khí CO2 (đktc) vào 1 lít dd gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Tính giá trị của x?
> Lời giải:
- Theo bài ra, ta có:
nNaOH = V.CM = 1.0,025M = 0,025(mol)
nCa(OH)2 = V.CM = 1.0,0125M = 0,0125(mol)
⇒ nOH- = nNaOH + 2nCa(OH)2 = 0,05 (mol)
nCO2 = V/22,4 = 0,672/22,4 = 0,03 (mol)
- Phương trình phản ứng:
CO2 + OH- → HCO3- (1)
0,03(mol)
HCO3- + OH- → CO32- + H2O (2)
0,02(mol)
Ca2+ + CO32- → CaCO3↓ (3)
0,0125(mol) ?
Theo PTPƯ (3) số mol CaCO3 là 0,0125 mol.
Vậy khối lượng CaCO3 kết tủa thu được là:
⇒ x = 0,0125.100 = 1,25 g.
* Bài tập 6: Cho 9,125 gam muối hiđrocacbon phản ứng hết với dung dịch H2SO4 (dư), thu được dung dịch chứa 7,5 gam muối sunfat trung hòa. Xác định công thức của muối hiđrocacbon?
> Lời giải:
- Gọi công thức muối hiđrocacbonat là M(HCO3)n
- Ta có PTHH
2M(HCO3)n + nH2SO4 → M2(SO4)n + 2nCO2 + 2nH2O
- Theo PTHH, ta thấy:
2 mol M(HCO3)n → 1 mol M2(SO4)n thì khối lượng muối giảm là:
2.61n - 96n = = 122n - 96n = 26n (g)
Theo bài ra, x mol M(HCO3)n → M2(SO4)n thì khối lượng muối giảm là:
9,125 - 7,5 = 1,625 (g)
nên suy ra: 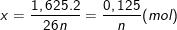
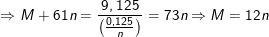
Cặp nghiệm phù hợp là: n = 2 và M = 24 (Mg)
⇒ Công thức của muối hiđrocacbonat là Mg(HCO3)2.
* Bài tập 7: Hấp thụ hoàn toàn 2,24 lít (đktc) CO2 vào 100ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít. Sau khi các phản ứng xảy ra hoàn toàn được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư được 11,82 gam kết tủa. Tính giá trị x?
> Lời giải:
- Theo bài ra, ta có: nCO2 = V/22,4 = 2,24/22,4 = 0,1 (mol)
Số mol K2CO3 là (100ml = 0,1lit):
nK2CO3 = V.CM = 0,1.0,2 = 0,02(mol)
Tương tự, số mol KOH là: nKOH = 0,1x (mol);
Số mol BaCO3 là: nBaCO3 = m/M = 11,82/197 = 0,06 (mol);
Giả sử dung dịch Y gồm 0,06 mol K2CO3 và y mol KHCO3.
Bảo toàn nguyên tố C và K cho ta hệ:
0,06 + y = 0,1 + 0,02 = 0,12
và 0,12 + y = 0,04+ 0,1x
⇒ x = 1,4 và y = 0,06.
Kết luận: nồng độ của KOH là 1,4(mol/l)
Hy vọng với bài viết chuyên đề các dạng bài tập về muối cacbonat và cách giải ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại dưới phần nhận xét để hayhochoi ghi nhận và hỗ trợ, chúc các em học tốt!
Đánh giá & nhận xét
-
 Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 44 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
Giải bài 9 trang 12 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
Giải bài 8 trang 11 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 7 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 6 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 5 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
Giải bài 4 trang 9 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
Giải bài 3 trang 8 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 2 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
Giải bài 1 trang 7 Hóa 12 Kết nối tri thức SGK
-
 Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 38 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 38 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 29 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 29 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 29 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 29 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 29 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 29 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 4 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 4 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 23 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 23 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 20 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 20 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 20 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 20 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 20 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 20 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 14 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 14 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 14 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 14 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 3 trang 10 Hóa 12 Chân trời sáng tạo SGK
Giải bài 3 trang 10 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 2 trang 10 Hóa 12 Chân trời sáng tạo SGK
Giải bài 2 trang 10 Hóa 12 Chân trời sáng tạo SGK
-
 Giải bài 1 trang 10 Hóa 12 Chân trời sáng tạo SGK
Giải bài 1 trang 10 Hóa 12 Chân trời sáng tạo SGK
-
 Ôn tập chương 8: Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất? Hóa 12 bài 30 KNTT (Kết nối tri thức)
Ôn tập chương 8: Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất? Hóa 12 bài 30 KNTT (Kết nối tri thức)
-
 Tính chất và Ứng dụng của phức chất? Phản ứng tạo phức chất và phản ứng thế phối tử phức chất? Hóa 12 bài 29 KNTT
Tính chất và Ứng dụng của phức chất? Phản ứng tạo phức chất và phản ứng thế phối tử phức chất? Hóa 12 bài 29 KNTT
-
 Khái niệm phức chất? dạng hình học của phức chất và liên kết trong phức chất? Hóa 12 bài 28 KNTT
Khái niệm phức chất? dạng hình học của phức chất và liên kết trong phức chất? Hóa 12 bài 28 KNTT
-
 Đơn chất và hợp chất kim loại chuyển tiếp dãy thứ nhất, đặc điểm cấu tạo, tính chất vật lí? Hóa 12 bài 27 KNTT
Đơn chất và hợp chất kim loại chuyển tiếp dãy thứ nhất, đặc điểm cấu tạo, tính chất vật lí? Hóa 12 bài 27 KNTT
-
 Ôn tập chương 7: Pin điện và điện phân? Hóa 12 bài 26 KNTT (Kết nối tri thức)
Ôn tập chương 7: Pin điện và điện phân? Hóa 12 bài 26 KNTT (Kết nối tri thức)
-
 Nguyên tố nhóm IIA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IIA? Hóa 12 bài 25 KNTT
Nguyên tố nhóm IIA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IIA? Hóa 12 bài 25 KNTT
-
 Nguyên tố nhóm IA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IA? Hóa 12 bài 24 KNTT
Nguyên tố nhóm IA: Đặc điểm, tính chất vật lí, tính chất hóa học đơn chất và hợp chất nhóm IA? Hóa 12 bài 24 KNTT
-
 Ôn tập chương 6: Đại cương về Kim loại? Hóa 12 bài 23 KNTT (Kết nối tri thức)
Ôn tập chương 6: Đại cương về Kim loại? Hóa 12 bài 23 KNTT (Kết nối tri thức)


















































