Cách tính theo phương trình hoá học và bài tập vận dụng - hoá 8 bài 22
Tính theo phương trình hóa học là một dạng bài tập quan trọng trong chương trình hóa học 8 nói riêng và hóa học bậc phổ thông nói chung.
Vậy làm sao để tính theo phương trình hoá học? có các dạng bài tập nào liên quan tới tính theo phương trình hoá học chúng ta cùng tìm hiểu qua bài viết dưới đây.
I. Cách tính theo phương trình hoá học
1. Tính theo phương trình hoá học là gì?
- Hiểu đơn giản tính theo phương trình hóa học là dựa vào phương trình hóa học đã được cân bằng để tính số mol của một chất đã biết, sau đó suy ra số mol của chất tham gia hoặc sản phẩm được tạo thành. Việc tính số mol sẽ được dựa trên khối lượng hoặc thể tích của các chất đã được cho trước.
2. Phương pháp tính theo phương trình hoá học.
- Để giải được các dạng bài tập tính theo phương trình hoá học lớp 8 ta cần nắm vững các nội dung sau:
- Chuyển đổi giữa khối lượng chất hoặc thể tích chất khí thành số mol chất
- Viết chính xác phương trình hoá học xảy ra.
- Dựa vào phương trình hoá học để tìm số mol chất tham gia hoặc chất tạo thành.
- Chuyển đổi số mol thành khối lượng (m = n.M) hoặc thể tích chất khí ở ĐKTC (V= n.22,4).
II. Các dạng bài tập tính theo phương trình hoá học
1. Tính khối lượng, thể tích chất tham gia hoặc sản phẩm được tạo thành
* Với dạng bài tập này, đề bài sẽ cho trước khối lượng hoặc thể tích của chất tham gia hoặc chất tạo thành, các bước thực hiện như sau:
- Tìm số mol chất đề bài cho: n = m/M hoặc n = V/22,4
- Lập phương trình hoá học
- Dựa vào tỉ lệ các chất có trong phương trình tìm ra số mol chất cần tìm
- Chuyển đổi ra số gam hoặc thể tích chất cần tìm.
* Ví dụ: Cho 2,4 gam Mg tác dụng với axit clohiđric HCl, tính:
a) Tính thể tích lượng khí thu được sau phản ứng (đktc)?
b) Tính khối lượng axit đã tham gia vào phản ứng?
Lời giải:
- Theo bài ra ta có số mol Mg là: nMg = 2,4/24 = 0,1 (mol)
- Phương trình hoá học:
Mg + 2HCl → MgCl2 + H2↑
1 mol 2 mol 1 mol
0,1 mol ? mol ? mol
- Dựa theo tỉ lệ số mol phản ứng giữa Mg với HCl và tỉ lệ với H2 tạo ra, ta có thể viết như ở trên và dễ dàng tính được số mol HCl tham gia phản ứng và số mol H2 tạo thành.
nH2 = nMg = 0,1 mol; nHCl = 2.nMg = 2.0,1 = 0,2 (mol)
a) Thể tích khí H2 thu được là: VH2 = n.22,4 = 0,1.22,4 = 2,24 (lít)
b) Khối lượng HCl tham gia phản ứng là: mHCl = n.M = 0,2.36,5 = 7,3 (g).
2. Tìm chất dư trong phản ứng.
* Với dạng bài này, chúng ta sẽ biết thể tích hoặc khối lượng của cả 2 chất tham gia, các bước thực hiện như sau:
- Giả sử phương trình phản ứng là: aA + bB → cC + dD
- Lập tỉ số: 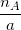 và
và 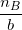 trong đó, nA và nB lần lượt là số mol chất A, chất B theo bài ra.
trong đó, nA và nB lần lượt là số mol chất A, chất B theo bài ra.
- So sánh tỉ số:
Nếu 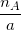 >
> 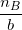 thì chất B hết , chất A dư
thì chất B hết , chất A dư
Nếu 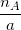 <
<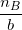 thì chất A hết, chất B dư
thì chất A hết, chất B dư
- Tính các lượng chất theo chất phản ứng hết.
* Ví dụ: Đốt cháy 6,2 gam Photpho trong bình chứa 6,72 lít khí Oxi ở đktc. Hãy cho biết sau khi cháy
a) Photpho hay oxi chất nào còn dư?
b) Chất nào được tạo thành và khối lượng là bao nhiêu gam?
Lời giải:
a) Xác định chất dư
- Theo bài ra ta có:
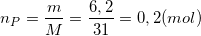
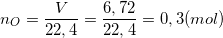
- Phương trình phản ứng
4P + 5O2 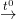 2P2O5
2P2O5
- Lập tỉ lệ: 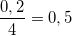 <
< 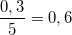 nên Photpho hết, Oxi dư.
nên Photpho hết, Oxi dư.
⇒ Ta sẽ tính toán theo lượng chất đã dùng hết là 0,2 mol P
b) Chất được tạo thành : P2O5
- Phương trình hoá học:
4P + 5O2 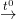 2P2O5
2P2O5
4 mol 2 mol
0,2 mol x? mol
⇒ x = 0,2.2/4 = 0,1 mol.(quy tắc nhân chéo chia ngang).
⇒ Khối lượng P2O5: mP2O5 = n.M = 0,1.142 = 14,2 (g).
3. Tính hiệu suất của phản ứng.
- Trong thực tế, một phản ứng hoá học xảy ra phụ thuộc vào rất nhiều yếu tố như nhiệt độ, chất xúc tác,...làm cho chất tham gia phản ứng không tác dụng hết, nghĩa là hiệu suất dưới 100%. Hiệu suất của phản ứng được tính theo một trong 2 cách sau:
* Cách 1: Hiệu suất phản ứng liên quan đến khối lượng sản phẩm:
H% = 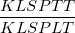 .100%
.100%
- Trong đó: KLSPTT là khối lượng sản phẩm thực tế; KLSPLT là khối lượng sản phẩm lý thuyết.
* Cách 2: Hiệu suất phản ứng liên quanđến chất tham gia:
H% = 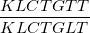 .100%
.100%
- Trong đó: KLCTGTT là khối lượng chất tham gia thực tế; KLCTGLT là khối lượng chất tham gia lý thuyết.
* Lưu ý:
- Khối lượng thực tế là khối lượng đề bài cho
- Khối lượng lý thuyết là khối lượng tính theo phương trình
* Ví dụ: Nung 150 kg CaCO3 thu được 67,2 kg CaO. Tính hiệu suất phản ứng.
Lời giải:
- Phương trình phản ứng:
CaCO3 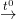 CaO + CO2
CaO + CO2
100 kg 56 kg
150 kg x? kg
- Khối lượng CaO thu được (theo lý thuyết tức là theo PTPƯ) là:
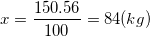
- Hiệu suất phản ứng là: H% = 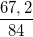 .100% = 80%
.100% = 80%
III. Bài tập áp dụng cách tính theo Phương trình hoá học
* Bài 1 trang 75 sgk hoá 8: Sắt tác dụng với axit clohiđric : Fe + 2HCl → FeCl2 + H2↑. Nếu có 2,8g sắt tham gia phản ứng em hãy tìm:
a) Thể tích khí hiđro thu được ở đktc.
b) Khối lượng axit clohiđric cần dùng.
>> Giải bài 1 trang 75 sgk hoá 8
* Bài 2 trang 75 sgk hoá 8: Lưu huỳnh (S) cháy trong không khí sinh ra chất khí mùi hắc, gây ho đó là lưu huỳnh đioxit (khí sunfurơ) có công thức hóa học là SO2.
a) Viết phương trình hóa học của lưu huỳnh cháy trong không khí.
b) Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6g. Hãy tìm.
- Thể tích khí sunfurơ sinh ra ở đktc.
- Thể tích không khí cần dùng ở đktc. Biết oxi chiếm 1/5 thể tích không khí.
>> Giải bài 2 trang 75 sgk hoá 8
* Bài 3 trang 75 sgk hoá 8: Có phương trình hóa học sau: CaCO3 → Cao + CO2.
a) Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2g CaO?
b) Muốn điều chế được 7g CaO cần dùng bao nhiêu gam CaCO3?
c) Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc).
d) Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng.
>> Giải bài 3 trang 75 sgk hoá 8
* Bài 4 trang 75 sgk hoá 8: a) Cacbon oxit CO tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hóa học.
b) Nếu muốn đốt cháy 20 ml CO thì phải dùng bao nhiêu mol O2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất?
c) Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp CO và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hóa học.
>> Giải bài 4 trang 75 sgk hoá 8
* Bài 5 trang 76 sgk hoá 8: Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A. Biết rằng:
- Khí A có tỉ lệ khối đối với không khí là 0,552.
- Thành phần theo khối lượng của khí A là: 75% C và 25% H.
Các thể tích khí đo ở đktc.
Hy vọng với phần hệ thống lại kiến thức về cách tính theo phương trình hoá học và các dạng toán liên quan giúp ích cho các em. Mọi thắc mắc vui lòng để lại bình luận dưới bài viết để được hỗ trợ, nếu bài viết hay hãy chia sẻ, chúc các em học tốt.
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét

















-
 Bảng tính tan trong nước của một số chất? Hỏi đáp Hóa học 8
Bảng tính tan trong nước của một số chất? Hỏi đáp Hóa học 8
-
 Công thức tính độ tan S (lớp 8) của một chất trong nước? Hỏi đáp Hóa học 8
Công thức tính độ tan S (lớp 8) của một chất trong nước? Hỏi đáp Hóa học 8
-
 Bảng hóa trị của các nguyên tố hóa học và Bảng hóa trị của một số nhóm nguyên tử - Hóa lớp 8
Bảng hóa trị của các nguyên tố hóa học và Bảng hóa trị của một số nhóm nguyên tử - Hóa lớp 8
-
 Giải bài 1 trang 79 SGK Hoá 8: Luyện tập mol, khối lượng mol, thể tích mol, tỉ khối chất khí
Giải bài 1 trang 79 SGK Hoá 8: Luyện tập mol, khối lượng mol, thể tích mol, tỉ khối chất khí
-
 Giải bài 1 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 1 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 2 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 2 trang 100 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 3 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 3 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 4 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 4 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 5 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 5 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 6 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 6 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 7 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 7 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 8 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
Giải bài 8 trang 101 SGK Hoá 8: Luyện tập điều chế Oxi, phân loại Oxít, Sự Oxi hoá, phản ứng phân huỷ, phản ứng hoá hợp
-
 Giải bài 1 trang 131 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 1 trang 131 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 2 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 2 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 3 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 3 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 4 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 4 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 5 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
Giải bài 5 trang 132 SGK Hoá 8: Luyện tập tính chất của nước, định nghĩa, phân loại, cách gọi tên Axit, Bazơ, Muối
-
 Giải bài 1 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 1 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 2 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 2 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 3 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 3 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 4 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 4 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 5 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
Giải bài 5 trang 149 SGK Hoá 8: Cách pha chế, pha loãng một dung dịch theo nồng độ cho trước
-
 Giải bài 1 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 1 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 2 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 2 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 3 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 3 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 6 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 6 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 5 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 5 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Giải bài 4 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
Giải bài 4 trang 151 SGK Hoá 8: Luyện tập Công thức tính nồng độ phần trăm, nồng độ mol, cách pha chế dung dịch
-
 Nồng độ Mol, Nồng độ phần trăm của dung dịch: Bài tập luyện tập - Hóa 8 bài 44
Nồng độ Mol, Nồng độ phần trăm của dung dịch: Bài tập luyện tập - Hóa 8 bài 44
-
 Cách Pha chế dung dịch theo nồng đồ cho trước và Cách tính để pha loãng dung dịch - Hóa 8 bài 43
Cách Pha chế dung dịch theo nồng đồ cho trước và Cách tính để pha loãng dung dịch - Hóa 8 bài 43
-
 Axit, Bazơ, Muối và Nước: Bài tập luyện tập về Axit Bazơ Muối - Hóa 8 bài 38
Axit, Bazơ, Muối và Nước: Bài tập luyện tập về Axit Bazơ Muối - Hóa 8 bài 38
-
 Bài tập luyện tập về Oxi, Oxit, Sự Oxi hóa, Phản ứng hóa hợp và phản ứng phân hủy - Hóa 8 bài 29
Bài tập luyện tập về Oxi, Oxit, Sự Oxi hóa, Phản ứng hóa hợp và phản ứng phân hủy - Hóa 8 bài 29
-
 Giải bài 4 trang 75 SGK Hoá 8: Cách tính theo phương trình hoá học
Giải bài 4 trang 75 SGK Hoá 8: Cách tính theo phương trình hoá học
-
 Giải bài 2 trang 60 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
Giải bài 2 trang 60 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
-
 Giải bài 1 trang 60 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
Giải bài 1 trang 60 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
-
 Giải bài 5 trang 61 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
Giải bài 5 trang 61 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
-
 Giải bài 4 trang 61 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
Giải bài 4 trang 61 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
-
 Giải bài 3 trang 61 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
Giải bài 3 trang 61 SGK Hoá 8: Luyện tập phản ứng hoá học, phương trình hoá học, định luật bảo toàn khối lượng
-
 Bài tập luyện tập phản ứng hóa học, định luật bảo toàn khối lượng và phương trình hóa học - Hóa 8 bài 17
Bài tập luyện tập phản ứng hóa học, định luật bảo toàn khối lượng và phương trình hóa học - Hóa 8 bài 17


















































