Bài tập về Lưu huỳnh (S), Lưu huỳnh dioxit SO2 và Hidro sunfua H2S - hoá lớp 10
Lưu huỳnh (S) cũng là một nguyên tố quan trọng trong nhiều hợp chất của nó tương tự như Oxi vì vậy cũng có khá nhiều dạng toán về lưu huỳnh mà chúng ta cần luyện tập để có kỹ năng giải nhuần nhuyễn.
Vì vậy trong bài viết này, chúng ta cùng tìm hiểu và vận dụng giải một số dạng bài tập về lưu huỳnh (S), các hợp chất của lưu huỳnh như: lưu huỳnh đioxit SO2 và hidro sunfua H2S,... để các em có thể giải thành thạo và đạt điểm cao khi gặp các dạng bài tập về lưu huỳnh.
Cũng như bất kỳ bài tập hoá nào, để giải được các bài toán về lưu huỳnh trước hết các em phải nắm vững các tính chất vật lý, hoá học,...của lưu huỳnh, nếu như chưa, các em có thể tham khảo ở liên kết sau:
• xem thêm: Tính chất hoá học của Lưu huỳnh và các hợp chất của Lưu huỳnh
I. Một số nội dung lý thuyết vận dụng để giải bài tập
1. Định luật bảo toàn khối lượng
• mchất = ∑mcác thành phần = ∑mcác nguyên tố
- Ví dụ: mH2SO4 = mH + mO + mS
• ∑mtrước phản ứng = ∑msau phản ứng
- Ví dụ: Al + O2 → Al2O3
⇒ mAl + mO2 = mAl2O3
2. Định luật bảo toàn Electron
• Tổng số electron cho = Tổng số electron nhận: ∑e cho = ∑e nhận
• Tổng số mol e cho = Tổng số mol e nhận: ∑e cho = ∑e nhận
⇒ (số e cho).(số mol chất cho) = (số e nhận).(số mol chất nhận)
- Ví dụ: Al + O2 → Al2O3
⇒ Bảo toàn e: 3.nAl = 4.nO2
3. Định luật bảo toàn Nguyên tố
• Trong phản ứng hoá học, các nguyên tố luôn được bảo toàn (không đổi).
⇒ Khối lượng nguyên tố không đổi
⇒ Số mol nguyên tố không đổi
⇒ ∑[(số nguyên tử).(số mol)]trước = ∑[(số nguyên tử).(số mol)]sau
- Ví dụ: FeO + O2 → Fe3O4
⇒ Bảo toàn O: 1.mFe + 2.nO2 = 4nFe3O4
- Lưu ý: Các bài tập có nhiều phản ứng oxi hoá khử, chúng ta không nên giải theo phương pháp truyền thống mà nên ưu tiên áp dụng các định luật bảo toàn trên để giải các dạng bài tập này.
II. Một số lưu ý khi giải bài tập về lưu huỳnh và hợp chất của lưu huỳnh
- Một số muối sunfua như Na2S, K2S, BaS, CaS,... tan trong nước, còn lại ầu hết các muối sunfua không tan trong nước.
- Một số muối sunfua không tan trong nước, nhưng tan trong dung dịch axit như FeS, ZnS, MgS,...
- Một số muối sunfua không tan trong nước và cũng không tan trong các dung dịch axit (HCl, H2SO4 loãng, HNO3 loãng,...) như CuS, PbS,...
+ Hầu hết muối sunfat đều tan trong nước. Một số muối sunfat không tan trong nước và không tan trong cả axit mạnh (HCl, HNO3,...) như BaSO4, SrSO4, PbSO4,...
+ Khi giải bài tập chúng ta nên áp dụng định luật bảo toàn nguyên tố, bảo toàn electron và bảo toàn khối lượng,...
III. Bài tập về lưu huỳnh và hợp chất của lưu huỳnh
Bài tập 1: Hấp thụ 7,84 lít (đktc) khí H2S vào 64 gam dung dịch CuSO4 10%, sau phản ứng hoàn toàn thu được m gam kết tủa đen. Tính giá trị của m?
* Lời giải:
- Theo bài ra ta có: nH2S = 7,84/22,4 = 0,35(mol).
- Từ công thức C%= (mct/mdd).100% ⇒ mCuSO4 = (C%.mdd)/100% = (10.64)/100 = 6,4 (g)
⇒ nCuSO4 = 6,4/160 = 0,04(mol)
- Phương trình phản ứng:
H2S + CuSO4 → CuS↓đen + H2SO4
- Theo bài ra và PTPƯ, ta thấy: nH2S = 0,35 > 0,04 = nCuSO4 nên H2S dư và CuSO4 phản ứng hết.
⇒ nCuS = nCuSO4 = 0,04(mol) ⇒ mCuS = 0,04.96 = 3,84(g).
Bài tập 2: Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và FeS trong dung dịch HCl dư thu được dung dịch Y và thoát ra 4,928 lít hỗn hợp khí Z. Cho hỗn hợp khí Z qua dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa đen. Tính thành phần phần trăm về khối lượng của FeS trong hỗn hợp X?
* Lời giải:
- Tóm tắt bài toán: m gam X (Fe, FeS) -qua HCl dư→ Y (FeCl2, HCl dư) + 4,982 lít khí Z (H2, H2S) -qua Pb(NO3)2→ 47,8g PbS↓
• Cách 1: Phương pháp giải theo PTPƯ ( phương pháp truyền thống)
- Gọi x, y lần lượt là số mol Fe, FeS trong hỗn hợp X
- Ta có phương trình phản ứng:
Fe + 2HCl → FeCl2 + H2↑
x mol x mol
FeS + 2HCl → FeCl2 + H2S
y mol y mol
H2S + Pb(NO3)2 → FeS + HNO3
y mol y mol
- Ta có: 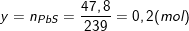 ;
; 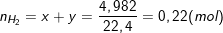
⇒ x = 0,02(mol).
⇒ %mFeS 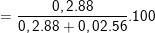 ≈94,02%
≈94,02%
• Cách 2: Áp dụng định luật bảo toàn
- Theo định luật bảo toàn nguyên tố S, ta có: nFeS = nH2S = nPbS = 47,8/239 = 0,2(mol).
- Ta có: nZ = nH2 + nH2S = 4 ,982/22,4 = 0,22(mol).
⇒ nH2 = 0,22 - 0,2 = 0,002 (mol).
- Theo định luật bảo toàn electron (số electron nhường = số electron nhận) thì: nFe = nH2 = 0,02(mol).
⇒ %mFeS 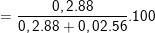 ≈94,02%
≈94,02%
Bài tập 3: Nung 5,6 gam bột sắt Fe và 13 gam kẽm Zn với một lượng dư bột lưu huỳnh, sau phản ứng thu được rắn X. Hòa tan hoàn toàn X trong dung dịch axit clohidric HCl thu được khí Y. Dẫn khí Y vào V lít dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được m gam kết tủa. Tìm m?
* Lời giải:
- Sơ đồ bài toán: (5,6 gam Fe và 13 gam Zn) + S → Rắn X (FeS, ZnS, S dư) + HCl → Khí Y (H2S) + CuSO4 → m gam CuS
• Cách 1: Phương pháp giải theo PTPƯ
- Ta có: nFe = 5,6/56 = 0,1(mol); nZn = 13/65 = 0,2(mol);
Fe + S → FeS
Zn + S → ZnS
FeS + HCl → FeCl2 + H2S
ZnS + HCl → ZnCl2 + H2S
H2S + CuSO4 → CuS + H2SO4
- Theo PTPƯ ta có: nCuS = nH2S = nFeS + nZnS = nFe + nZn = 0,1 + 0,2 = 0,3(mol).
⇒ mCuS = 0,3.96 = 28,8(g).
• Cách 2: Áp dụng định luật bảo toàn
- Theo định luật bảo toàn electron thì: số e nhường = số e nhận
- Mà Fe nhường 2e ; Zn nhường 2e ; còn S nhận 2e nên ta có: 2nFe + 2nZn = 2nS
⇒ nS = nFe + nZn = 0,1 + 0,2 = 0,3(mol).
- Theo định luật bảo toàn nguyên tố ta có: nCuS = nS = 0,3(mol)
⇒ mCuS = 0,3.96 = 28,8(g).
* Như vậy ta thấy việc áp dụng các định luật bảo toàn giúp chúng ta giải bài toán nhanh hơn, gọn và chính xác ⇒ đặc biệt thuận lợi đối với các bài toán hiện nay thi trắc nghiệm.
Bài tập 4: Thêm từ từ dung dịch BaCl2 vào 300ml dung dịch Na2SO4 1M cho đến khi khối lượng kết tủa bắt đầu không đổi thì dừng lại, thấy hết 500 ml. Tính nồng độ mol/l của dung dịch BaCl2.
* Lời giải:
- Theo bài ra ta có: nNa2SO4 = CM.V =1.0,3 = 0,3(mol).
- Phản ứng đến khi kết tủa không đổi, tức là Na2SO4 đã hết.
- Phương trình phản ứng:
Na2SO4 + BaCl2 → BaSO4↓ trắng + 2NaCl
- Theo PTPƯ, ta có: nBaCl2 = nNa2SO4 = 0,3(mol).
⇒ CM (Na2SO4) = n/V = 0,3/0,5 = 0,6(M).
Bài tập 5: Cho 2,24 lit (đktc) khí H2S hấp thụ hết vào 85 ml dung dịch NaOH 2M, sau phản ứng thu được dung dịch X. Xác định các chất trong dng dịch X?
* Lời giải:
- Theo bài ra, ta có: nH2S = 2,24/22,4 = 0,01(mol). nNaOH = 0,085.2 = 0,17(mol).
- Ta tính tỉ lệ mol của NaOH và H2S: 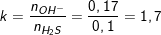
- Ta thấy, 1<k=1,7<2 nên dung dịch X có 2 muối là Na2S và NaHS
- Phương trình phản ứng:
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + H2O
* Một số lưu ý:
♦ Khi H2S, SO2 tác dụng với dung dịch bazo sẽ tạo ra muối axit hay muối trung hòa phụ thuộc vào số mol của chúng với số mol OH-. Gọi 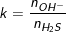 hoặc
hoặc 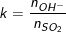 thì:
thì:
° k ≤ 1: chỉ tạo muối HS1- (muối HSO31-) và H2S dư (SO2 dư)
° 1<k<2: tạo 2 muối HS1- và S2- (HSO31- và HSO32-)
° K ≥ 2: chỉ tạo muối S2- (SO32-) và OH- dư
♦ Khi giải bài tập chúng ta nên áp dụng định luật bảo toàn nguyên tố, bảo toàn khối lượng
Bài tập 6: Cho 2,24 lít SO2 (đktc) hấp thụ hết vào 150 ml dung dịch NaOH 1M thu được dung dịch Y. Tính khối lượng muối có trong dung dịch Y.
* Lời giải:
- Theo bài ra ta có: nSO2 = 2,24/22,4 = 0,1(mol). nNaOH = 0,15.1 = 0,15(mol).
- Lập tỉ lệ số mol: 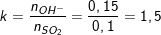
- Ta thấy, 1<k=1,5<2 nên dung dịch X có 2 muối là NaHSO3 và Na2SO3
• Cách 1: Giải bằng cách dựa vào phương trình phản ứng
- Gọi x, y lần lượt là số mol của NaHSO3 và Na2SO3
- Phương trình phản ứng:
SO2 + NaOH → NaHSO3
x x x(mol)
SO2 + 2NaOH → Na2SO3 + H2O
y 2y y(mol)
- Theo bài ra va theo ptpư ta có: nSO2 = x + y = 0,1(mol). (*)
nNaOH = x + 2y = 0,15(mol). (**)
- Giải hệ (*) và (**) ta được: x = y = 0,05(mol).
⇒ mNaHSO3 = 0,05.104 = 5,2(g)
⇒ mNa2SO3 = 0,05.126 = 6,3(g)
⇒ mmuối = mNaHSO3 + mNa2SO3 = 5,2 + 6,3 = 11,5(g).
• Cách 2: Giải bằng cách dựa vào các định luật bảo toàn
- ĐLBT nguyên tố S, ta có: 1.nNaHSO3 + 1.nNa2SO3 = 1.nSO2 = 1.0,1=0,1(mol) (*)
- ĐLBT nguyên tố Na, ta có: 1.nNaHSO3 + 2.nNa2SO3 = 1.nNaOH = =1.0,15 = 0,15(mol) (**)
- Từ (*) và (**) ta có: nNaHSO3 = nNa2SO3 = 0,05(mol)
⇒ mmuối = mNaHSO3 + mNa2SO3 = 0,05.104 + 0,05.126 = 5,2 + 6,3 = 11,5(g).
* Nhận xét: Thực tế cho thấy cách giải 1 chỉ áp dụng cho các bài toán đơn giản, có ít phương trình phản ứng và cách này học sinh chúng ta quen ở các lớp học dưới nên thấy dễ hiểu, còn cách giải 2 áp dụng cho các bài toán phức tạp có nhiều PTPƯ các em cần làm quen với cách giải này để vận dụng tốt cho việc thi trắc nghiệm.
Bài tập 7: Đốt cháy hoàn toàn 6,8 gam khí H2S thu được V lít SO2 (đktc) và m gam hơi nước. Hấp thụ toàn bộ SO2 ở trên vào 200 gam dung dịch NaOH 5,6% thì thu được dung dịch Y. Tính nồng độ phần trăm của chất tan có phân tử khối lớn hơn trong Y?
* Lời giải:
- Theo ĐLBT nguyên tố S: nSO2 = nH2S =6,8/34 = 0,2(mol).
- Theo bài ra, ta có: mNaOH = (5,6.200)/100 = 11,2(g) ⇒ nNaOH = 11,2/40 = 0,28(mol).
- Lập tỉ lệ số mol: 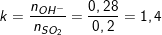
- Ta thấy, 1<k=1,4<2 nên dung dịch X có 2 muối là NaHSO3 và Na2SO3
• Cách 1: Giải bằng cách dựa vào phương trình phản ứng
- Các phương trình phản ứng:
2H2S + 3O2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_04/1554368429l4kg73wp1x.gif) 2SO2 + 2H2O
2SO2 + 2H2O
0,2 mol 0,2
SO2 + NaOH → NaHSO3
x x x(mol)
SO2 + 2NaOH → Na2SO3 + H2O
y 2y y(mol)
- Theo bài ra va theo ptpư ta có: nSO2 = x + y = 0,2(mol). (*)
nNaOH = x + 2y = 0,28(mol). (**)
- Giải hệ (*) và (**) ta được: x = 0,12(mol) ;y = 0,08(mol).
⇒ nNaHSO3 = 0,12(mol) ; nNa2SO3 = 0,08(mol).
- Khối lượng dung dịch sau phản ứng là: mdd = mdd (NaOH) + mSO2 = 200 + 0,2.64 = 212,8 (g).
⇒ C%Na2SO4 = [0,08.126)/212,8].100% = 4,74%
• Cách 2: Giải bằng cách dựa vào các định luật bảo toàn
- ĐLBT nguyên tố S, ta có: 1.nNaHSO3 + 1.nNa2SO3 = 1.nSO2 = 1.0,2=0,2(mol) (*)
- ĐLBT nguyên tố Na, ta có: 1.nNaHSO3 + 2.nNa2SO3 = 1.nNaOH = =1.0,28 = 0,28(mol) (**)
- Giải hệ pt (*) và (**) ta được: nNaHSO3 = 0,12(mol) ; nNa2SO3 = 0,08(mol).
- Khối lượng dung dịch sau phản ứng là: mdd = mdd NaOH + mSO2 = 200 + 0,2.64 = 212,8 (g).
⇒ C%Na2SO4 = [0,08.126)/212,8].100% = 4,74%
Bài tập 8: Đốt cháy hoàn toàn m gam S có trong oxi dư, hấp thụ toàn bộ sản phẩm cháy vào 120 ml dung dịch NaOH 1M thì thu được dung dịch chứa 2 muối có cùng nồng độ mol. Tính m?
* Lời giải:
- Phản ứng của lưu huỳnh cháy trong khí oxi: O2 + S → SO2;
- SO2 tác dụng với dung dịch NaOH thu được 2 muối là NaHSO3 và Na2SO3. Vì 2 muối có nồng độ bằng nhau nên chúng có số mol bằng nhau NaHSO3 Na2SO3 ⇒ nNaHSO3 = nNa2SO3
- Theo ĐLBT nguyên tố Na: 1.nNaHSO3 + 2.nNa2SO3 = 1.nNaOH = 0,12 ⇒ nNaHSO3 = nNa2SO3 = 0,04 (mol);
- Theo ĐLBT nguyên tố S: nS = 1.nNaHSO3 + 1.nNa2SO3 =0,08 ⇒ mS = 0,08.32 = 2,56(g).
Bài tập 9: Dẫn 3,36 lít khí H2S (đktc) vào 250 ml dung dịch KOH 2M, sau khi phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được m gam rắn khan. Tính m?
* Lời giải:
- Ta có: nH2S = 3,36/22,4 = 0,15(mol); nKOH = 0,25.2 = 0,5(mol).
- Ta có: 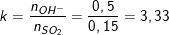
- Ta thấy, 2<k nên dung dịch X chỉ có muối K2S và KOH dư
- Theo ĐLBT nguyên tố S: 1.nK2S = 1.nH2S = 0,15 (*)
- Theo ĐLBT nguyên tố K: 1.nKOH (ban đầu) =2.nK2S + 1.nKOH (dư) ⇒ nKOH (dư) = 0,5 - 0,15.2 = 0,2 (**)
- Giải hệ pt (*) và (**) ta được: mrắn = mK2S + mKOH (dư) = 0,15.110 + 0,2.56 = 27,7(g).
Hy vọng với phần hệ thống lại một số dạng bài tập về lưu huỳnh, lưu huỳnh dioxit và hidro sunfua cùng các bài tập có hướng dẫn ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét


-
 Giải Hóa học 10 trang 20 - Kết nối tri thức
Giải Hóa học 10 trang 20 - Kết nối tri thức
-
 Giải Hóa học 10 trang 18 - Kết nối tri thức
Giải Hóa học 10 trang 18 - Kết nối tri thức
-
 Giải Hóa học 10 trang 17 - Kết nối tri thức
Giải Hóa học 10 trang 17 - Kết nối tri thức
-
 Giải Hóa học 10 trang 16 - Kết nối tri thức
Giải Hóa học 10 trang 16 - Kết nối tri thức
-
 Giải Hóa học 10 trang 15 - Kết nối tri thức
Giải Hóa học 10 trang 15 - Kết nối tri thức
-
 Giải Hóa học 10 trang 14 - Kết nối tri thức
Giải Hóa học 10 trang 14 - Kết nối tri thức
-
 Giải Hóa học 10 trang 13 - Kết nối tri thức
Giải Hóa học 10 trang 13 - Kết nối tri thức
-
 Giải Hóa học 10 trang 8 - Kết nối tri thức
Giải Hóa học 10 trang 8 - Kết nối tri thức
-
 Giải Hóa học 10 trang 7 - Kết nối tri thức
Giải Hóa học 10 trang 7 - Kết nối tri thức
-
 Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 42 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 34 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 5 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 4 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 4 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 3 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 3 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 2 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 2 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 1 trang 15 Hóa 10 Cánh Diều SGK
Giải bài 1 trang 15 Hóa 10 Cánh Diều SGK
-
 Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 25 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 3 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 2 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
Giải bài 1 trang 19 SGK Hoá 10 Chân trời sáng tạo
-
 Phản ứng oxi hoá khử, cách lập phương trình hoá học và bài tập - hoá 10 bài 17
Phản ứng oxi hoá khử, cách lập phương trình hoá học và bài tập - hoá 10 bài 17
-
 Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
Orbital nguyên tử là gì? Nguyên lý Pauli và quy tắc Hund là gì? Lớp, phân lớp và cấu hình electron - Hoá 10 bài 4 CTST
-
 Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Ôn tập chương 7: Nguyên tố nhóm Halogen? Hóa 10 bài 23 KNTT (Kết nối tri thức)
Ôn tập chương 7: Nguyên tố nhóm Halogen? Hóa 10 bài 23 KNTT (Kết nối tri thức)
-
 Tính chất hóa học của HydroHalic acid, muối Halide? Cấu tạo và tính chất vật lí của hydrogen Halide? Hóa 10 bài 22 KNTT
Tính chất hóa học của HydroHalic acid, muối Halide? Cấu tạo và tính chất vật lí của hydrogen Halide? Hóa 10 bài 22 KNTT
-
 Tính chất hóa học, tính chất vật lí của Halogen? Trạng thái tự nhiên, Cấu tạo nguyên tử Halogen? Hóa 10 bài 21 KNTT
Tính chất hóa học, tính chất vật lí của Halogen? Trạng thái tự nhiên, Cấu tạo nguyên tử Halogen? Hóa 10 bài 21 KNTT
-
 Ôn tập chương 6: Tốc độ phản ứng? Hóa 10 bài 20 KNTT (Kết nối tri thức)
Ôn tập chương 6: Tốc độ phản ứng? Hóa 10 bài 20 KNTT (Kết nối tri thức)
-
 Tốc độ phản ứng là gì? Các yếu tố ảnh hưởng tới tốc độ của phản ứng? Hóa 10 bài 19 KNTT
Tốc độ phản ứng là gì? Các yếu tố ảnh hưởng tới tốc độ của phản ứng? Hóa 10 bài 19 KNTT
-
 Ôn tập chương 5: Biến thiên Enthalpy trong các phản ứng hóa học? Hóa 10 bài 18 KNTT (Kết nối tri thức)
Ôn tập chương 5: Biến thiên Enthalpy trong các phản ứng hóa học? Hóa 10 bài 18 KNTT (Kết nối tri thức)


















































