Một số Bazo quan trọng, tính chất hóa học của Natri Hidroxit NaOH, Canxi Hidroxit Ca(OH)2 - hóa 9 bài 8
Trong bài trước các em đã được học về tính chất hóa học của bazo, trong bài viết này chúng ta sẽ tìm hiểu về một số bazo quan trọng đó là Natri hidroxit NaOH và Canxi hidroxit Ca(OH)2
Vậy Natri hidroxit NaOH và Canxi hidroxit Ca(OH)2 có những tính chất hóa học cụ thể nào? được điều chế như thế nào và có những ứng dụng gì trong thực tế mà được gọi là một trong những bazo quan trọng, chúng ta cùng tìm hiểu qua bài viết này.
A. NATRI HIDROXIT - NaOH
- Công thức hóa học: NaOH
- Tên gọi: Natri hidroxit
- Khối lượng phân tử: 40
I. Tính chất vật lý của Natri hidroxit
- Là chất rắn, không màu, hút ẩm mạnh, tan nhiều trong nước.
- Dung dịch Natri hidroxit có tính nhờn làm bục vải, giấy và ăn mòn da. Vì vậy, khi sử dụng Natri hidroxit NaOH phải hết sức cẩn thận.
II. Tính chất hóa học của Natri hidroxit
- Natri hidroxit có đầy đủ tính chất hóa học của 1 bazơ
1. Làm đổi màu chất chỉ thị
- Làm quỳ tím đổi thành màu xanh.
- Làm phenolphthalein không màu đổi sang màu đỏ.
2. Natri hidroxit tác dụng với oxit axit
- PTPƯ: NaOH + Oxit axit → Muối + Nước
- Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai.
Ví dụ: 2NaOH + CO2 → Na2CO3 + H2O
2NaOH + SO2 → Na2SO3 + H2O
NaOH + SiO2 → Na2SiO3 (*)
- Phản ứng (*) là phản ứng ăn mòn thủy tinh (NaOH ở nhiệt độ nóng chảy) vì thế khi nấu chảy NaOH, người ta dùng các dụng cụ bằng sắt, niken hay bạc mà không dùng thủy tinh để chứa NaOH.

3. Natri hidroxit tác dụng với axit
- PTPƯ: NaOH + Axit → Muối + Nước
Ví dụ: NaOH + HCl → NaCl + H2O
2NaOH + H2SO4 → Na2SO4 + H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
4. Natri hidroxit tác dụng với muối
- PTPƯ: NaOH + Muối → Muối mới + Bazo mới
- Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Ví dụ: 2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓ nâu đỏ
3NaOH + FeCl3 → 3NaCl + Fe(OH)3 ↓
5. Dung dịch NaOH có khả năng hoà tan : Al, Al2O3 , Al(OH)3
Ví dụ: 2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑
2NaOH + Al2O3 → 2NaAlO2 + H2O
NaOH + Al(OH)3 → NaAlO2 + 2H2O
- Tương tự, NaOH có thể tác dụng với kim loại Be, Zn, Sb, Pb, Cr và oxit và hiđroxit tương ứng của chúng
6. Natri hidroxit tác dụng với một số phi kim như Si, C, P, S, Halogen:
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
C + NaOHnóng chảy → 2Na + 2Na2CO3 + 3H2↑
4P trắng + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH → NaCl + NaClO3 + 3H2O
III. Điều chế và ứng dụng của Natri hidroxit
1. Điều chế Natri hidroxit
- Phương pháp hóa học:
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
- Nếu cần một lượng nhỏ, rất tinh khiết, người ta cho kim loại kiềm tác dụng với nước:
Na + H2O → NaOH + H2↑
- Phương pháp điện phân dung dịch NaCl bão hòa (có màng ngăn):
2NaCl + 2H2O ![small xrightarrow[]{dp}](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/15527916500r3hzyhztm_1630714913_1630796630.gif) 2NaOH + Cl2↑ +H2↑
2NaOH + Cl2↑ +H2↑
2. Ứng dụng của Natri hidroxit
- Natri hidroxit được dùng để sản xuất xà phòng, giấy, tơ nhân tạo, tinh dầu thực vật và các sản phẩm chưng cất dầu mỏ, chế phẩm nhuộm và dược phẩm nhuộm.
- Natri hidroxit còn được sử dụng để làm khô khí và là thuốc thử rất thông dụng trong phòng thí nghiệm.
B. Canxi hidroxit - Ca(OH)2
- Công thức hóa học của Canxihidroxit: Ca(OH)2
- Khối lượng phân tử: 74
- Tên gọi: Canxi hidroxit
- Tên thông thường: Vôi tôi
I. Tính chất vật lý của Canxi hidroxit
-Dung dịch trong nước gọi là nước vôi trong. Nước vôi trắng là huyền phù của Ca(OH)2 trong nước. Vôi bột là Ca(OH)2 ở dạng bột.
II. Tính chất hóa học của Canxi hidroxit
- Ca(OH)2 có đầy đủ tính chất chung của một bazơ
1. Canxi hidroxit tác dụng với chất chỉ thị
- Làm quỳ tím hóa xanh
- Làm phenolphthalein không màu đổi sang màu đỏ.
2. Canxihidroxit tác dụng với axit
- PTPƯ: Ca(OH)2 + Axit → Muối + Nước
Ví dụ: Ca(OH)2 + 2HCl → CaCl2 + 2H2O
3Ca(OH)2 + 2H3PO4 → Ca3(PO4)2 + 6H2O
3. Canxi hidroxit tác dụng với oxit axit
- PTPƯ: Ca(OH)2 + Oxit Axit → Muối + Nước
Ca(OH)2 + SO2 → CaSO3 + H2O
- Thổi CO2 vào nước vôi trong làm vẩn đục do tạo thành kết tủa CaCO3, tiếp tục thổi nữa thì kết tủa tan tạo thành dung dịch trong suốt:
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCO3 + CO2 + H2O → Ca(HCO3)2
4. Canxi hidroxit tác dụng với dung dịch muối
- PTPƯ: Ca(OH)2 + Muối → Muối mới+ Bazo mới
Ví dụ: Ca(OH)2 + Na2CO3 → CaCO3↓+ NaOH
- Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
III. Điều chế và ứng dụng của Canxi hidroxit
1. Điều chế Canxi hidroxit
CaO + H2O → Ca(OH)2
2. Ứng dụng của Canxi hidroxit
- Làm vật liệu xây dựng
- Khử chua đất trồng trọt, khử độc, khử trùng, diệt nấm
C. Thang PH biểu thị độ axit hoặc bazơ của dung dịch
• PH = 7: Dung dịch trung tính (nước cất có PH = 7)
• PH < 7: Dung dịch có tính axit, PH càng nhỏ độ axit càng lớn.
• PH > 7: Dung dịch có tính bazơ, PH càng lớn độ axit càng lớn
D. Bài tập về Natri hidroxit và Canxi hidroxit
* Bài 1 trang 27 SGK Hóa 9: Có 3 lọ không nhãn, mỗi lọ đựng một chất rắn sau: NaOH, Ba(OH)2, NaCl. Hãy trình bày cách nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học nếu có.
>> Lời giải bài 1 trang 27 SGK Hóa 9
* Bài 2 trang 27 SGK Hóa 9: Có những chất sau: Zn, Zn(OH)2, NaOH, Fe(OH)3, CuSO4, NaCl, HCl. Hãy chọn những chất thích hợp điền vào sơ đồ phản ứng sau và lập phương trình hóa học.
a) ... → Fe2O3 + H2O
b) H2SO4 + ... → Na2SO4 + H2O
c) H2SO4 + ... → ZnSO4 + H2O
d) NaOH + ... → NaCl + H2O
e) ... + CO2 → Na2CO3 + H2O.
>> Lời giải bài 2 trang 27 SGK Hóa 9
* Bài 3 trang 27 SGK Hóa 9: Dẫn từ từ 1,568 lít khí CO2(đktc) vào một dung dịch có hòa tan 6,4g NaOH. Sản phẩm là muối Na2CO3.
a) Chất nào đã lấy dư và dư là bao nhiêu (lít hoặc gam)?
b) Hãy xác định muối thu được sau phản ứng.
>> Lời giải bài 3 trang 27 SGK Hóa 9
* Bài 1 trang 30 SGK Hóa 9: Viết các phương trình hóa học thực hiện các chuyển đổi hóa học sau:
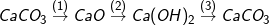
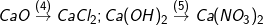
>> Lời giải bài 1 trang 30 SGK Hóa 9
* Bài 2 trang 30 SGK Hóa 9: Có ba lọ không nhãn, mỗi lọ đựng một trong ba chất rắn màu trắng sau: CaCO3, Ca(OH)2, CaO. Hãy nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết phương trình hóa học.
>> Lời giải bài 2 trang 30 SGK Hóa 9
* Bài 3 trang 30 SGK Hóa 9: Hãy viết các phương trình hóa học khi cho dung dịch NaOH tác dụng với dung dịch H2SO4 tạo ra:
a) Muối natri hiđrosunfat.
b) Muối natri sunfat.
* Bài 4 trang 30 SGK Hóa 9: Một dung dịch bão hòa khí CO2 trong nước có pH = 4. Hãy giải thích và viết phương trình hóa học của CO2 với nước.
>> Lời giải bài 4 trang 30 SGK Hóa 9
Hy vọng với bài viết về một số bazo quan trọng, tính chất hóa học của Natri hidroxit NaOH, Canxi hidroxit Ca(OH)2 và bài tập vận dụng ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
|
¤ Nội dung cùng chương 1: » Bài 6: Thực Hành Tính Chất Hóa Học Của Oxit Và Axit » Bài 7: Tính Chất Hóa Học Của Bazơ » Bài 9: Tính Chất Hóa Học Của Muối » Bài 10: Một Số Muối Quan Trọng ¤ Có thể bạn muốn xem: |
Đánh giá & nhận xét
-
 Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
Giải KHTN 9 trang 134 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
Giải KHTN 9 trang 132 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
Giải KHTN 9 trang 131 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
Giải KHTN 9 trang 130 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
Giải KHTN 9 trang 129 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
Giải KHTN 9 trang 128 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
Giải KHTN 9 trang 127 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
Giải KHTN 9 trang 126 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
Giải KHTN 9 trang 125 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
Giải KHTN 9 trang 124 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
Giải KHTN 9 trang 123 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
Giải KHTN 9 trang 122 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
Giải KHTN 9 trang 121 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
Giải KHTN 9 trang 120 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
Giải KHTN 9 trang 119 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
Giải KHTN 9 trang 118 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
Giải KHTN 9 trang 117 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
Giải KHTN 9 trang 116 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
Giải KHTN 9 trang 115 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
Giải KHTN 9 trang 114 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
Giải KHTN 9 trang 113 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
Giải KHTN 9 trang 112 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
Giải KHTN 9 trang 111 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
Giải KHTN 9 trang 110 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
Giải KHTN 9 trang 109 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
Giải KHTN 9 trang 108 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
Giải KHTN 9 trang 107 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
Giải KHTN 9 trang 106 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
Giải KHTN 9 trang 105 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
Giải KHTN 9 trang 104 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
Giải KHTN 9 trang 103 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
Giải KHTN 9 trang 102 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
Giải KHTN 9 trang 100 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
Giải KHTN 9 trang 99 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
Giải KHTN 9 trang 98 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
Giải KHTN 9 trang 97 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
Giải KHTN 9 trang 96 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 95 Chân trời sáng tạo SGK
Giải KHTN 9 trang 95 Chân trời sáng tạo SGK
-
 Giải KHTN 9 trang 94 Chân trời sáng tạo SGK
Giải KHTN 9 trang 94 Chân trời sáng tạo SGK


















































