Bài tập luyện tập về thành phần cấu tạo nguyên tử nguyên tố hóa học - Hóa 10 bài 3
Các bài học trước các em đã được giới thiệu về thành phần nguyên tử, hạt nhân nguyên tử nguyên tố hóa học và đồng vị.
Bài này sẽ giúp các em củng cố kiến thức về thành phần cấu tạo nguyên tử, hạt nhân nguyên tử, kích thước khối lượng, điện tích của các hạt. Định nghĩa nguyên tố hóa học, ký hiệu nguyên tử, đồng vị, nguyên tử khối trung bình.
I. Kiến thức về thành phần nguyên tử, nguyên tố hóa học
1. Nguyên tử được cấu tạo nên bởi electron và hạt nhân. Hạt nhân được tạo nên bởi proton và nơtron
• qe = - 1,602.10-19 C, quy ước bằng 1– ; me = 0,00055u
• qp= +1,602.10-19 C ,quy ước bằng 1+ ; mp = 1u
• qn = 0 ; mn = 1u
2. Trong nguyên tử, số đơn vị điện tích hạt nhân Z = số proton = số electron
• Số khối A = Z + N
• Nguyên tử khối coi như bằng tổng số các proton và các nơtron (gần đúng).
• Nguyên tử khối của một nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của đồng vị đó.
• Nguyên tố hóa học là những nguyên tử có cùng số Z.
• Các đồng vị của một nguyên tố hóa học là các nguyên tử có cùng số Z , khác số N.
3. Số hiệu nguyên tử Z và số khối A đặc trưng cho nguyên tử
• Kí hiệu nguyên tử: 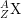

II. Bài tập về thành phần nguyên tử, nguyên tố hóa học
* Bài 1 trang 18 SGK Hóa 10: Theo số liệu ở bảng 1 Bài 1 trang 8:
a) Hãy tính khối lượng g của nguyên tử nitơ (gồm 7 proton, 7 notron, 7 electron) (Đây là phép tính gần đúng).
b) Tính tỉ số khối lượng của electron trong nguyên tử so với khối lượng của toàn nguyên tử.
* Lời giải:
a) Tổng khối lượng của electron: 7.(9,1.10-28) = 63,7.10-28g
- Tổng khối lượng của proton: 7.(1,67.10-24) = 11,69.10-24g
- Tổng khối lượng của notron: 7.(1,675.10-24) = 11,72.10-24g
⇒ Khối lượng của nguyên tử nitơ: = me + mp + mn = 23,43.10-24g.
b) Tỉ số khối lượng của electron trong nguyên tử so với khối lượng của toàn nguyên tử là:
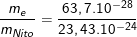
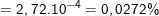
* Bài 2 trang 18 SGK Hóa 10: Tính nguyên tử khối trung bình của kali biết rằng trong tự nhiên thành phần % các đồng vị của kali là:
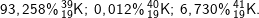
* Lời giải:
- Nguyên tử khối trung bình của kali là:
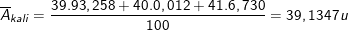
* Bài 3 trang 18 SGK Hóa 10: a) Định nghĩa nguyên tố hóa học.
b) Kí hiệu nguyên tử thể hiện những đặc trưng gì cho nguyên tử một nguyên tố hóa học, lấy thí dụ với nguyên tố kali.
* Lời giải:
a) Nguyên tố hóa học bao gồm các nguyên tử có cùng số đơn vị điện tích hạt nhân.
b) Kí hiệu nguyên tử: 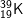
• Kí hiệu trên cho ta biết:
- Số hiệu nguyên tử của nguyên tố K là 19, số đơn vị điện tích hạt nhân nguyên tử là 19, trong hạt nhân có 19 proton và (39 – 19 = 20) nơtron. Vỏ electron của nguyên tử K có 19 electron.
- Nguyên tử khối của K là 39u.
* Bài 4 trang 18 SGK Hóa 10: Căn cứ vào đâu mà người ta biết chắc chắn rằng giữa nguyên tố hiđro (Z = 1) và nguyên tố urani (Z = 92) chỉ có 90 nguyên tố.
* Lời giải:
- Từ H có Z = 1, urani có Z = 92 có tất cả 92 nguyên tố vì số hiệu của các ô trong bảng tuần hoàn là một dãy số tự nhiên tăng dần và không có ô trống giữa các số này (như số thứ tự). Vậy trừ H và U chỉ còn 90 nguyên tố ở khoảng giữa 2 nguyên tố.
* Bài 5 trang 18 SGK Hóa 10: Tính bán kính gần đúng của nguyên tử canxi biết thể tích của 1 mol canxi tinh thể bằng 25,87 cm3.
(Cho biết: Trong tinh thể, các nguyên tử canxi chỉ chiếm 74% thể tích, còn lại là khe trống).
* Lời giải:
- Ta có: 1 mol chứa khoảng 6,02.1023 nguyên tử nên thể tích của 1 nguyên tử canxi là:
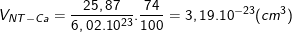
Mặt khác lại có: 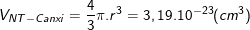
Nên suy ra: ![\small r=\sqrt[3]{\frac{3,19.10^{-23}}{\frac{4}{3}\pi }}=1,96.10^{-8}cm=0,196nm](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/1631434943u0ebnx3uz1_1631435965.gif)
* Bài 6 trang 18 SGK Hóa 10: Viết công thức của các loại phân tử đồng (II) oxit, biết rằng đồng và oxi có các đồng vị sau:
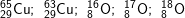
* Lời giải:
- Với 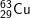 có các oxit sau:
có các oxit sau: 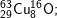
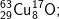
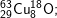
- Với 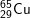 có các oxit sau:
có các oxit sau: 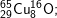
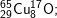
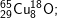
Hy vọng với phần Bài tập luyện tập về thành phần cấu tạo nguyên tử nguyên tố hóa học các em đã rèn luyện được kỹ năng xác định số electron, số proton, số nơtron, và nguyên tử khối khi biết ký hiệu nguyên tử.
¤ Xem thêm các bài viết khác tại:
Đánh giá & nhận xét
-
 Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Quy tắc Hund là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
Nội dung Nguyên lý PAULI là gì, Ví dụ, Hóa 10 - Hỏi đáp nhanh
-
 Ôn tập chương 7: Nguyên tố nhóm Halogen? Hóa 10 bài 23 KNTT (Kết nối tri thức)
Ôn tập chương 7: Nguyên tố nhóm Halogen? Hóa 10 bài 23 KNTT (Kết nối tri thức)
-
 Tính chất hóa học của HydroHalic acid, muối Halide? Cấu tạo và tính chất vật lí của hydrogen Halide? Hóa 10 bài 22 KNTT
Tính chất hóa học của HydroHalic acid, muối Halide? Cấu tạo và tính chất vật lí của hydrogen Halide? Hóa 10 bài 22 KNTT
-
 Tính chất hóa học, tính chất vật lí của Halogen? Trạng thái tự nhiên, Cấu tạo nguyên tử Halogen? Hóa 10 bài 21 KNTT
Tính chất hóa học, tính chất vật lí của Halogen? Trạng thái tự nhiên, Cấu tạo nguyên tử Halogen? Hóa 10 bài 21 KNTT
-
 Ôn tập chương 6: Tốc độ phản ứng? Hóa 10 bài 20 KNTT (Kết nối tri thức)
Ôn tập chương 6: Tốc độ phản ứng? Hóa 10 bài 20 KNTT (Kết nối tri thức)
-
 Tốc độ phản ứng là gì? Các yếu tố ảnh hưởng tới tốc độ của phản ứng? Hóa 10 bài 19 KNTT
Tốc độ phản ứng là gì? Các yếu tố ảnh hưởng tới tốc độ của phản ứng? Hóa 10 bài 19 KNTT
-
 Ôn tập chương 5: Biến thiên Enthalpy trong các phản ứng hóa học? Hóa 10 bài 18 KNTT (Kết nối tri thức)
Ôn tập chương 5: Biến thiên Enthalpy trong các phản ứng hóa học? Hóa 10 bài 18 KNTT (Kết nối tri thức)
-
 Phản ứng tỏa nhiệt, phản ứng thu nhiệt là gì? Ý nghĩa Biến thiên Enthalpy là gì? Hóa 10 bài 17 KNTT
Phản ứng tỏa nhiệt, phản ứng thu nhiệt là gì? Ý nghĩa Biến thiên Enthalpy là gì? Hóa 10 bài 17 KNTT
-
 Ôn tập chương 4: Phản ứng oxi hóa - khử? Hóa 10 bài 16 KNTT (Kết nối tri thức)
Ôn tập chương 4: Phản ứng oxi hóa - khử? Hóa 10 bài 16 KNTT (Kết nối tri thức)
-
 Phản ứng Oxi hóa - khử? Quy tắc xác định số Oxi hóa, chất oxi hóa, chất khử, lập PTHH ôxi hóa khử? Hóa 10 bài 15 KNTT
Phản ứng Oxi hóa - khử? Quy tắc xác định số Oxi hóa, chất oxi hóa, chất khử, lập PTHH ôxi hóa khử? Hóa 10 bài 15 KNTT
-
 Ôn tập chương 3: Liên kết hóa học? Hóa 10 bài 14 KNTT (Kết nối tri thức)
Ôn tập chương 3: Liên kết hóa học? Hóa 10 bài 14 KNTT (Kết nối tri thức)
-
 Bản chất liên kết Hydrogen? Khái niệm tương tác Van der Waals và sự ảnh hưởng? Hóa 10 bài 13 KNTT
Bản chất liên kết Hydrogen? Khái niệm tương tác Van der Waals và sự ảnh hưởng? Hóa 10 bài 13 KNTT
-
 Sự tạo thành liên kết cộng hóa trị? Phân tử có liên kết đơn, liên kết đôi và liên kết ba? Hóa 10 bài 12 KNTT
Sự tạo thành liên kết cộng hóa trị? Phân tử có liên kết đơn, liên kết đôi và liên kết ba? Hóa 10 bài 12 KNTT
-
 Liên kết ion là gì? Sự tạo thành liên kết ion, tinh thể ion, tính chất của hợp chất ion? Hóa 10 bài 11 KNTT
Liên kết ion là gì? Sự tạo thành liên kết ion, tinh thể ion, tính chất của hợp chất ion? Hóa 10 bài 11 KNTT
-
 Quy tắc OCTET, Khái niệm liên kết hóa học? Hóa 10 bài 10 KNTT
Quy tắc OCTET, Khái niệm liên kết hóa học? Hóa 10 bài 10 KNTT
-
 Ôn tập chương 2: Bảng tuần hoàn các nguyên tố hóa học, Định luật tuần hoàn? Hóa 10 bài 9 KNTT (Kết nối tri thức)
Ôn tập chương 2: Bảng tuần hoàn các nguyên tố hóa học, Định luật tuần hoàn? Hóa 10 bài 9 KNTT (Kết nối tri thức)
-
 Định luật tuần hoàn Mendeleev, Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học? Hóa 10 bài 8 KNTT
Định luật tuần hoàn Mendeleev, Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học? Hóa 10 bài 8 KNTT
-
 Tính chất của các Oxide và Hydroxide, Thành phẩn của các Oxide và Hydroxide? Hóa 10 bài 7 KNTT
Tính chất của các Oxide và Hydroxide, Thành phẩn của các Oxide và Hydroxide? Hóa 10 bài 7 KNTT
-
 Độ âm điện của nguyên tử là gì? Sự biến đổi tính kim loại và tính phi kim trong một nhóm, chu kỳ? Hóa 10 bài 6 KNTT
Độ âm điện của nguyên tử là gì? Sự biến đổi tính kim loại và tính phi kim trong một nhóm, chu kỳ? Hóa 10 bài 6 KNTT
-
 Cấu tạo bảng tuần hoàn, nguyên tắc sắp xếp các nguyên tố, ô nguyên tố, chu kì, nhóm? Hóa 10 bài 5 KNTT
Cấu tạo bảng tuần hoàn, nguyên tắc sắp xếp các nguyên tố, ô nguyên tố, chu kì, nhóm? Hóa 10 bài 5 KNTT
-
 Ôn tập chương 1: Cấu tạo nguyên tử? Hóa 10 bài 4 KNTT (Kết nối tri thức)
Ôn tập chương 1: Cấu tạo nguyên tử? Hóa 10 bài 4 KNTT (Kết nối tri thức)
-
 Cách viết cấu hình Electron nguyên tử? Biểu diễn cấu hình E theo orbital? đặc điểm lớp E ngoài cùng? Hóa 10 bài 3 KNTT
Cách viết cấu hình Electron nguyên tử? Biểu diễn cấu hình E theo orbital? đặc điểm lớp E ngoài cùng? Hóa 10 bài 3 KNTT
-
 Nguyên tử khối là gì? Công thức tính nguyên tử khối trung bình? Kí hiệu nguyên tử, nguyên tố hóa học? Hóa 10 bài 2 KNTT
Nguyên tử khối là gì? Công thức tính nguyên tử khối trung bình? Kí hiệu nguyên tử, nguyên tố hóa học? Hóa 10 bài 2 KNTT
-
 Cấu tạo Nguyên tử? Kích thước, khối lượng của nguyên tử, điện tích hạt nhân và số khối? Hóa 10 bài 1 KNTT
Cấu tạo Nguyên tử? Kích thước, khối lượng của nguyên tử, điện tích hạt nhân và số khối? Hóa 10 bài 1 KNTT
-
 Đối tượng nghiên cứu hóa học, vai trò của hóa học trong đời sống sản xuất và cách học? Hóa 10 bài mở đầu KNTT
Đối tượng nghiên cứu hóa học, vai trò của hóa học trong đời sống sản xuất và cách học? Hóa 10 bài mở đầu KNTT
-
 Mục lục SGK Hóa 10 Kết nối tri thức - Lý thuyết và bài tập Hóa 10 SGK Kết nối tri thức
Mục lục SGK Hóa 10 Kết nối tri thức - Lý thuyết và bài tập Hóa 10 SGK Kết nối tri thức
-
 Tính chất vật lí của Hydrogen Halide, tính axit của Hydrohalic, tính khử của các ion Halide - Hoá 10 bài 18 CTST
Tính chất vật lí của Hydrogen Halide, tính axit của Hydrohalic, tính khử của các ion Halide - Hoá 10 bài 18 CTST
-
 Tính chất hoá học tính chất vật lí của Halogen, đặc điểm cấu tạo, trạng thái tự nhiên và ứng dụng của Halogen - Hoá 10 bài 17 CTST
Tính chất hoá học tính chất vật lí của Halogen, đặc điểm cấu tạo, trạng thái tự nhiên và ứng dụng của Halogen - Hoá 10 bài 17 CTST
-
 Các yếu tố ảnh hưởng tới tốc độ phản ứng: Nhiệt độ, nồng độ, áp suất, bề mặt tiếp xúc, chất xúc tác và ví dụ - Hoá 10 bài 16 CTST
Các yếu tố ảnh hưởng tới tốc độ phản ứng: Nhiệt độ, nồng độ, áp suất, bề mặt tiếp xúc, chất xúc tác và ví dụ - Hoá 10 bài 16 CTST
-
 Tốc độ phản ứng hoá học là gì? Công thức biểu thức tính tốc độ phản ứng - Hoá 10 bài 15 CTST
Tốc độ phản ứng hoá học là gì? Công thức biểu thức tính tốc độ phản ứng - Hoá 10 bài 15 CTST
-
 Tính biến thiên Enthalpy của phản ứng dựa vào enthalpy tạo thành và năng lượng liên kết - Hóa 10 bài 14 CTST
Tính biến thiên Enthalpy của phản ứng dựa vào enthalpy tạo thành và năng lượng liên kết - Hóa 10 bài 14 CTST
-
 Phản ứng tỏa nhiệt là gì? Phản ứng thu nhiệt là gì? Tính biến thiên Enthalpy của phản ứng hóa học- Hóa 10 bài 13 CTST
Phản ứng tỏa nhiệt là gì? Phản ứng thu nhiệt là gì? Tính biến thiên Enthalpy của phản ứng hóa học- Hóa 10 bài 13 CTST
-
 Phản ứng Oxi hóa Khử là gì? Cách lập phương trình phản ứng Oxi hóa Khử và Ý nghĩa trong cuộc sống - Hóa 10 bài 12 CTST
Phản ứng Oxi hóa Khử là gì? Cách lập phương trình phản ứng Oxi hóa Khử và Ý nghĩa trong cuộc sống - Hóa 10 bài 12 CTST
-
 Liên kết Hydrogen là gì? Tương tác Van Der Waals là gì? Vai trò và ảnh hưởng của liên kết Hydrogen, tương tác Van der waals - Hoá 10 bài 11 CTST
Liên kết Hydrogen là gì? Tương tác Van Der Waals là gì? Vai trò và ảnh hưởng của liên kết Hydrogen, tương tác Van der waals - Hoá 10 bài 11 CTST
-
 Sự hình thành liên kết cộng hoá trị, cách viết công thức Lewis, Liên kết cho nhận và sự hình thành liên kết xích ma, liên kết pi - Hoá 10 bài 10 CTST
Sự hình thành liên kết cộng hoá trị, cách viết công thức Lewis, Liên kết cho nhận và sự hình thành liên kết xích ma, liên kết pi - Hoá 10 bài 10 CTST
-
 Liên kết ion là gì? Sự hình thành liên kết ion? Ion âm, Ion dương là gì? Tinh thể ion là gì? - Hóa 10 bài 9 CTST
Liên kết ion là gì? Sự hình thành liên kết ion? Ion âm, Ion dương là gì? Tinh thể ion là gì? - Hóa 10 bài 9 CTST
-
 Quy tắc OCTET (Bát tử) là gì? Liên kết hóa học là gì, hình thành khi nào? Vận dụng quy tắc OCTET - Hóa 10 bài 8 CTST
Quy tắc OCTET (Bát tử) là gì? Liên kết hóa học là gì, hình thành khi nào? Vận dụng quy tắc OCTET - Hóa 10 bài 8 CTST
-
 Định luật tuần hoàn, Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học - Hoá 10 bài 7 CTST
Định luật tuần hoàn, Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học - Hoá 10 bài 7 CTST


















































