Bảng hoá trị các nguyên tố hoá học lớp 7 Chân trời sáng tạo
Hóa trị là khái niệm cơ bản và quan trọng nhất đối với học sinh bắt đầu làm quen với môn Hóa học lớp 7. Việc nắm vững hóa trị giúp chúng ta hiểu được khả năng liên kết của các nguyên tử và nhóm nguyên tử, từ đó xây dựng nên các công thức hóa học chính xác.
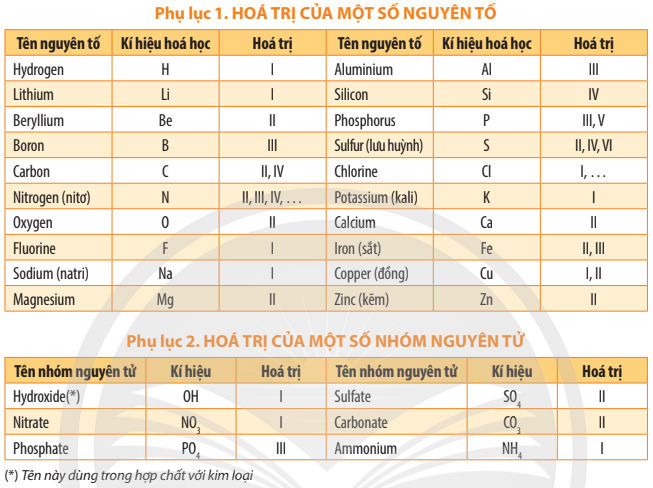
Bảng hóa trị lớp 7 được giới thiệu trong sách giáo khoa Chân trời sáng tạo là tài liệu "gối đầu giường", giúp quá trình lập công thức hóa học và xác định hóa trị của các nguyên tố trở nên dễ dàng và nhanh chóng. Bài viết này sẽ tổng hợp chi tiết hai phụ lục quan trọng về hóa trị và hướng dẫn cách bạn áp dụng chúng một cách hiệu quả nhất.
1. Hóa trị là gì? Khái Niệm Cơ Bản
Hóa trị của một nguyên tố hoặc nhóm nguyên tử là con số biểu thị khả năng liên kết của nguyên tố hoặc nhóm nguyên tử đó (khả năng kết hợp với nguyên tử khác). Hóa trị được quy ước lấy hóa trị của Hydrogen (H) làm đơn vị (H có hóa trị I).
2. Phụ lục 1. Bảng Hóa Trị của Một Số Nguyên Tố Hóa Học Lớp 7
Đây là bảng tập hợp các nguyên tố phổ biến, phân loại dựa trên hóa trị cố định (như H, Na, Mg, Al) và hóa trị thay đổi (như Fe, Cu, S). Việc ghi nhớ bảng này là yêu cầu bắt buộc để thực hành các bài tập hóa học cơ bản.
| Tên nguyên tố | Kí hiệu hóa học | Hóa trị |
| Hydrogen | H | I |
| Lithium | Li | I |
| Beryllium | Be | II |
| Boron | B | III |
| Carbon | C | II, IV |
| Nitrogen (nito) | N | II, III, IV, ... |
| Oxygen | O | II |
| Fluorine | F | I |
| Sodium (natri) | Na | I |
| Magnesium | Mg | II |
| Aluminium | Al | III |
| Silicon | Si | IV |
| Phosphorus | P | III, V |
| Sulfur (lưu huỳnh) | S | II, IV, VI |
| Chlorine | Cl | I, ... |
| Potassium (kali) | K | I |
| Calcium | Ca | II |
| Iron (sắt) | Fe | II, III |
| Copper (đồng) | Cu | I, II |
| Zinc (kẽm) | Zn | II |
3. Phụ lục 2. Bảng Hóa Trị của Một Số Nhóm Nguyên Tử Lớp 7
Nhóm nguyên tử là tập hợp các nguyên tử liên kết với nhau và hoạt động như một đơn vị, mang một hóa trị chung. Việc xác định hóa trị của nhóm nguyên tử rất quan trọng khi lập công thức của acid, base và muối.
| Tên nhóm nguyên tử | Kí hiệu | Hóa trị |
| Hydroxide(*) | OH | I |
| Nitrate | NO$_3$ | I |
| Phosphate | PO$_4$ | III |
| Sulfate | SO$_4$ | II |
| Carbonate | CO$_3$ | II |
| Ammonium | NH$_4$ | I |
(*) Lưu ý: Tên nhóm Hydroxide (OH) dùng trong hợp chất với kim loại (base).
 Bảng hoá trị các nguyên tố hoá học lớp 7 Chân trời sáng tạo
Bảng hoá trị các nguyên tố hoá học lớp 7 Chân trời sáng tạo
4. Ứng Dụng: Quy Tắc Hóa Trị và Cách Lập Công Thức
Quy tắc hóa trị là nguyên tắc cốt lõi để lập công thức hóa học: Trong một hợp chất hai nguyên tố (hoặc nhóm nguyên tử), tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
Đối với hợp chất có công thức $A_x B_y$, trong đó $A$ có hóa trị $a$ và $B$ có hóa trị $b$:
Các bước lập công thức cơ bản:
-
Viết Kí hiệu: Viết kí hiệu hóa học của hai nguyên tố hoặc nhóm nguyên tử.
-
Ghi Hóa trị: Ghi hóa trị ($a, b$) lên phía trên mỗi kí hiệu.
-
Áp dụng Quy tắc Chéo: Dùng quy tắc chéo ($x = b$; $y = a$).
-
Rút gọn (nếu cần): Nếu $a$ và $b$ có ước chung lớn nhất (UCLN) khác 1, cần chia cả $x$ và $y$ cho UCLN đó.
Việc thành thạo Bảng hóa trị lớp 7 không chỉ giúp bạn giải quyết các bài toán cơ bản về lập công thức một cách chính xác, mà còn xây dựng nền tảng vững chắc cho việc học các kiến thức Hóa học phức tạp hơn như phương trình hóa học, phản ứng trao đổi, hay tính toán theo công thức ở các lớp sau.
Hãy luôn giữ bảng hóa trị này bên cạnh trong quá trình học tập và luyện tập thường xuyên để các giá trị hóa trị được ghi nhớ một cách tự nhiên nhất.
Bạn có muốn thực hành lập công thức hóa học với một số cặp nguyên tố bất kỳ không? Hãy để lại bình luận để HayHocHoi hỗ trợ, chúc bạn học tốt.














































